Cancer de Pancreas
Transcript of Cancer de Pancreas

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 1
UUNNIIVVEERRSSIIDDAADD NNAACCIIOONNAALL
““PPEEDDRROO RRUUIIZZ GGAALLLLOO””
Facultad de Medicina HumanaFacultad de Medicina HumanaFacultad de Medicina HumanaFacultad de Medicina Humana
CÁNCER DE PÁNCREAS
Chiclayo, Chiclayo, Chiclayo, Chiclayo, octubre del 2010octubre del 2010octubre del 2010octubre del 2010
CIRUGÍA GENERAL Y
ABDOMINAL
ALUMNO:
Mondragón guerrero Edgar Wilson

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 2

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 3
CONTENIDO
INTRODUCCIÓN…………………………………………………………………..…4
OBJETIVOS…………………………………………………………………………...4
CONSIDERACIONES GENERALES………………………………………………5
CÁNCER DE PANCREAS……...………………………………………………..…12
Epidemiología………….………………………………………………….….…..12
Factores de riesgo……………………………………………………………….12
Biología molecular y cáncer de páncreas…………….…………………..……14
Clasificación………………………...………...………………...........................15
Presentación clínica………………………………...……………………………19
Diagnóstico……………………………..…………………………………..……..20
Diagnóstico diferencial…..……………………....……………………...……….24
Factores pronósticos…………….……..……….…………………...…………..25
Estadiaje………………..…..……………………………………………...……..27
Tratamiento……..…………..………………….…………………………………29
OTROS TUMORES DE PÁNCREAS EXOCRINOS……………………………..42
TUMORES ENDOCRINOS…..……..………………………………………………43
Insulinoma…..…………..…………………………………………………………44
Glucagonoma…..…………………………………………………………………47
CONCLUSIONES……………………………………………………….…………..49
BIBLIOGRAFÍA…………………………………………………………….………..49

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 4
I. INTRODUCCIÓN
El adenocarcinoma pancreático es una de las neoplasias más letales, con una
supervivencia global a los 5 años del 1-2%, situándose en la cuarta causa de muerte
por cáncer en los países occidentales. La incidencia estimada en EE.UU. durante el
año 2007 es de 33.000 casos, y casi todos ellos morirán debido a la enfermedad. La
supervivencia media es de 8 a 12 meses para pacientes con enfermedad localmente
avanzada e irresecable, y tan sólo de 3 a 6 meses en aquéllos con enfermedad a
distancia en el momento del diagnóstico, representando la cirugía la única opción
curativa. Sin embargo, se estima que sólo el 15-20% presentan enfermedad resecable
al diagnóstico. El pronóstico es pobre incluso en los casos quirúrgicos, con una
supervivencia a los 5 años, en casos resecados, que no supera el 20%.
II. OBJETIVOS:
OBJETIVO GENERAL
� Realizar una revisión teórica de las neoplasias del páncreas, en especial el
adenocarcinoma panceratico.
OBJETIVOS ESPECIFICOS
� Definir conceptos de patología neoplasia pancreática.
� Conocer la epidemiología y la importancia del cáncer de páncreas, así como
describir los factores involucrados para el desarrollo del mismo.
� Conocer los distintos tipos de neoplasias pancreáticas y su clasificación de
acuerdo a su origen e histología.
� Realizar una breve revisión de los marcadores tumorales y su importancia en el
diagnostico de neoplasias pancreáticas.
� Conocer el diagnostico, pronostico y tratamiento del cáncer gástrico.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 5
III. CONSIDERACIONES GENERALES
Embriología del Páncreas
El páncreas se desarrolla a partir de dos esbozos originados en el segmento del
intestino anterior correspondiente a la futura segunda porción duodenal. El esbozo
pancreático dorsal aparece a principios de la cuarta semana y crece rápidamente en el
mesenterio dorsal. El esbozo pancreático ventral aparece a fines de la cuarta semana
y puede originarse tanto en la base del esbozo hepático como en el duodeno
inmediatamente adyacente. Este origen variable del esbozo ventral explicaría las
diferentes formas anatómicas de la unión biliopancreática. Durante la quinta semana,
el esbozo ventral y la vía biliar principal rotan hacia la derecha, y como resultado, el
páncreas ventral se hace dorsal y se sitúa por detrás de la vena porta y por debajo del
páncreas dorsal. Hacia la sexta semana se fusionan los parénquimas y conductos
principales de ambos esbozos.
El conducto ventral crece más rápidamente que el segmento proximal del conducto
dorsal y de esta manera se convierte anatómica y funcionalmente en el segmento
proximal del conducto de Wirsung. Por su parte, el segmento proximal del conducto
dorsal puede persistir como conducto accesorio (conducto de Santorini) o
desaparecer. En la figura 39-2 se detallan las formas habituales de terminación de los
conductos pancreáticos en el adulto y sus frecuencias relativas.
Desarrollo embriológico de páncreas

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 6
Anatomía
El páncreas es un órgano retroperitoneal lobulado, de 10 a 15 cm de largo y 70 a 100
g de peso. Al examen macroscópico sólo está recubierto por una fina capa de tejido
conectivo que separa los lóbulos entre sí, de modo que, en condiciones normales, no
existe una verdadera cápsula pancreática. Hacia atrás, la glándula está separada de
los planos posteriores por tejido graso retroperitoneal.
Tradicionalmente se divide al páncreas en cabeza, cuello, cuerpo y cola. La cabeza se
sitúa a la altura de la segunda vértebra lumbar y está enmarcada por las tres primeras
porciones del duodeno. Hacia la izquierda, una prolongación de la cabeza se extiende
por detrás de la vena porta en forma de gancho (proceso uncinado). El cuello es un
pequeño segmento situado a la altura de la primera vértebra lumbar, en relación
inmediata hacia atrás con la vena porta y más hacia atrás con la columna. El cuerpo
se extiende desde el cuello hasta el hilio del bazo. Aunque anatómicamente la cola es
un segmento pequeño que ocupa el ligamento pancreaticoesplénico, es común
denominar cola del páncreas a la porción izquierda del cuerpo.
Si bien el páncreas se suele extender transversalmente hacia la izquierda y atrás, su
configuración es variable debido a los cambios de posición del cuerpo y la cola. El
conducto de Wirsung tiene un trayecto horizontal en la cola y el cuerpo: al llegar al
istmo, el trayecto se hace bruscamente anteroposterior. Para unirse por último al
colédoco en la papila.
La irrigación arterial del páncreas proviene del tronco celíaco y de la arteria
mesentérica superior. Tanto la cabeza como el gancho y el istmo, junto con la segunda
y tercera porción del duodeno, reciben su irrigación arterial de dos arcadas
pancrcaticoduodenales, una anterior y otra posterior, extendidas entre las arterias
gastroduodenal y mesentérica superior. El cuerpo y la cola están irrigados por ¡a
arteria esplénica y por la pancreática transversa, rama de la esplénica o de la
mesentérica superior.
El drenaje venoso del páncreas se realiza a través de venas que acompañan a las
arterias correspondientes. Mientras que el páncreas derecho drena en las venas
mesentérica superior y porta (eje venoso mesentericoportal), el páncreas izquierdo lo
hace en la vena esplénica.
El drenaje linfático se dirige a cinco grupos ganglionares.
Los grupos superior e inferior se localizan respectivamente en los bordes superior e
inferior de la cabeza y cuerpo pancreáticos.
El anterior comprende ganglios subpilóricos, pancreaticoduodenales anteriores y de la
raíz de los vasos mesentéricos, mientras que el posterior incluye ganglios

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 7
pericoledocianos, pancreaticoduodenales posteriores y lateroaórticos. Finalmente, el
grupo esplénico comprende ganglios del hilio del bazo, del borde superior e inferior de
la cola pancreática y del ligamento frenoesplénico.
Páncreas y su relación con órganos vecinos
Anatomía microscópica
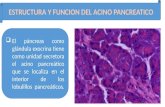
La unidad anatómica y funcional del páncreas exocrino es el ácino. Estudios
anatómicos recientes mediante microscopía electrónica han demostrado que la idea
tradicional sobre la anatomía acinar es incorrecta. El ácino no es una estructura oval
situada en el extremo terminal de un conducto, sino que su forma es variable y su
origen puede ser tanto en el extremo como a los lados de un conducto intercalar. De
esta manera, la arquitectura tubuloacinar es una compleja arborización que permite
incluso anastomosis de necesidad a través de la luz acinar.
El ácino está compuesto por células epiteliales prismáticas con escasas
microvellosidades en su superficie. Las regiones infranuclear y paranuclear del

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 8
citoplasma están ocupadas por el sistema membranoso del retículo endoplasmático,
mientras que el aparato de Golgi y los granulos de cimógeno se localizan hacia el polo
apical. El espacio entre una y otra célula acinar (intercelular) está sellado por
complejos sistemas de condensación filamentosa organizados en tándem. Este
mecanismo aisla por completo, en condiciones normales, la luz acinar del espacio
intercelular. Los conductos intercalares están formados por células cuboides que
penetran hasta el interior de la luz acinar y allí se las denomina células centroacinares.
Los conductos intercalares se continúan en los conductos intralobulares y éstos, a su
vez, en los interlobulares, que transcurren en el tejido conectivo interlobular y drenan
en el conducto de
Wirsung. Mientras que no existen diferencias morfológicas entre las células epiteliales
de los conductos intercalares e intralobulares, el epitelio de los conductos
interlobulares y del conducto de Wirsung está formado por células piramidales que
contienen abundantes granulos secretorios. Aunque el contenido de estos granulos no
ha sido aún suficientemente investí gado, estudios histoquímicos identificaron la
presencia de por lo menos cuatro tipos de mucoproteínas.
Páncreas porciones exocrina y endocrina

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 9
Estructura interna del páncreas
Fisiología de la secreción pancreática exocrina
El páncreas excreta diariamente alrededor de 15 g de enzimas diversas en
aproximadamente 2.000 ml de líquido. El denominado grupo de las proteasas incluye a
la tripsina, quimotripsina, elastasa, calicreína y carboxipeptidasas; otras enzimas
digestivas no proteásicas son la lipasa, fosfolipasa A , colipasas I y II,
carboxilesterhidrolasa y amilasa. El páncreas también es rico en enzimas lisosomales
como la p-D-glucuronidasa, a-D-glucosidasa, catepsina B y otras. La ribonucleasa y la
desoxirribonucleasa también forman parte de la secreción pancreática, aunque en
cantidades pequeñas.
Mientras que el papel de las enzimas digestivas es bien conocido, poco se sabe sobre
las funciones del resto de las enzimas pancreáticas. Las enzimas lisosomales
protegen a la célula de la acumulación de residuos y quizá también de la acumulación
patológica de enzimas digestivas. Paradójicamente, a las enzimas lisosomales se les

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 10
atribuye en la actualidad un papel patogénico en la pancreatitis aguda. La función de la
ribonucleasa y la desoxirribonucleasa es desconocida.
La síntesis de todas las enzimas pancreáticas se realiza en los ribosomas del retículo
endoplasmático, desde donde son transferidas al aparato de Golgi. Allí son
procesadas y separadas según sus funciones específicas. Las enzimas digestivas son
empaquetadas en vacuolas de condensación que luego se transforman en granulos
maduros de cimógeno, y las lisosomales son dirigidas hacia los compartimientos
endolisosomales. Los granulos de cimógeno se dirigen al polo apical de la célula y allí
son liberados en la luz acinar por exocitosis.
El páncreas está protegido por diferentes mecanismos de la acción destructora de sus
propias enzimas. En primer lugar, todas son sintetizadas como proteínas inactivas y
luego aisladas en granulos secretorios. En segundo lugar, existen inhibidores
intracelulares capaces de suprimir hasta el 80 % de la actividad de cualquier tripsina
activa, y por lo tanto, de evitar la activación en cascada. Además, el ácino es muy
resistente a la acción de cualquier enzima activa.
Por su parte, también el plasma posee mecanismos para inactivar enzimas que
pudieran pasar a la circulación. Los principales inhibidores plasmáticos de las
proteasas son la alfa 1- antitripsina, inter-alfa1-antitripsina, alfa2-macroglobulina y
antiquimotripsina.
La secreción exocrina del páncreas está regulada en tres fases: cefálica, gástrica e
intestinal. La secreción de la fase cefálica se debe a la acción del vago, ya sea por
medio de fibras colinérgicas y peptidérgicas, o a través de la liberación de gastrina. La
fase gástrica se inicia con la llegada de los alimentos al estómago y está mediada por
mecanismos nerviosos y humorales. Los mecanismos nerviosos comprenden reflejos
colinérgicos vagovagales gastropancreáticos, mientras que el mecanismo humoral
consiste en la liberación de gastrina.
La fase intestinal es la más importante de las tres y comienza con la llegada de los
alimentos al duodeno. Está mediada por reflejos colinérgicos vagovagales
enteropancreáticos y por la liberación de colecistoquinina y secretina. Existen además
otros péptidos estimulantes, tales como la sustancia P, bombesina, motilina,
polipéptido intestinal vasoactivo y neurotensina. Los mecanismos inhibidores de la
secreción pancreática, una vez que los alimentos han sido eliminados del duodeno,
son poco conocidos.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 11
Secreción pancreática: célula acinar

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 12
IV. CANCER DE PANCREAS
Es un tumor muy agresivo y de mal pronóstico que se desarrolla por degeneración
maligna de las células pancreáticas.
En los últimos años, su incidencia ha aumentado considerablemente, teniendo en
cuenta la creciente disponibilidad de mejores métodos diagnósticos para su detección
precoz.
Si bien representa sólo el 2 % de los tumores malignos, el cáncer de páncreas es la
cuarta causa de muerte por cáncer.
Es excepcional que se presente en personas jóvenes, con un pico de incidencia entre
los 50 y los 60 años de edad, predominando en los hombres; aunque en las últimas
décadas se ha incrementado la incidencia en las mujeres.
Si bien las causas desencadenantes no son claras, diversos estudios relacionan
fuertemente al tabaco y al alcohol, pero resulta muy controvertido este último. La
herencia juega un papel importante, ya que es más frecuente en familiares de
personas con este tumor. Los vegetales, las frutas, la vitamina C y los carotenos
proporcionan un efecto protector.
1. EPIDEMIOLOGÍA
La edad media de diagnóstico es de 60-65 años, siendo relativamente raro por debajo
de los 45 años. Es más frecuente en varones1 (ratio 1.3:1) y en raza negra, siendo su
incidencia a lo largo del mundo más elevada en países industrializados1 y más baja en
países asiáticos y africanos, lo que indica que los factores ambientales ligados al
“estilo de vida occidental” incrementan considerablemente su riesgo.
2. FACTORES DE RIESGO
Entre los factores de riesgo se encuentran:
Hereditarios
Se estima que aproximadamente un 10-15% tienen una base heredable. Diversos
estudios han demostrado que los familiares de primer grado de pacientes con cáncer
de páncreas tienen un riesgo mayor de desarrollar la enfermedad, con diferentes

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 13
patrones de agregación familiar. Los síndromes hereditarios con riesgo incrementado
de cáncer de páncreas se presentan en la.
Cáncer de páncreas con base heredable
Síndrome Genes Riesgo de cáncer de
páncreas (%)
Cancer de mama y ovario hereditario BRCA1-2 5
Sindrome melanoma familiar CDKN2A 19
Sindrome Peutz-Jehgers STK-11 36
Poliposis adenomatosa familiar APC ?
Sindrome de Lynch MLH1 MSH2 ?
Pancreatitis hereditaria PRSS1 SPINK1 40
Ataxia telangiectasia ATM ?
Sindrome Li-Fraumeni p53 ?
Pancreatitis crónica no hereditaria
Con un riesgo del 4% a los 20 años.
Diabetes miellitus
Aproximadamente un 15% de los pacientes se hacen diabéticos en los 6 meses
previos al diagnóstico de cáncer, probablemente por alteraciones en la función
pancreática secundarias a un tumor oculto, sin embargo se observa un riesgo dos
veces mayor de cáncer pancreático entre los pacientes con diabetes mellitus de larga
evolución.
Factores ambientales
Se estima que el riesgo de cáncer de páncreas está aumentado 1,5 veces en
fumadores, directamente relacionado con el número de cigarrillos consumidos y con
descenso del riesgo tras el cese del hábito, siendo el factor de riesgo más importante
(30%). La ingesta de grasas y la obesidad aumentan claramente el riesgo de cáncer
pancreático, mientras que el consumo de vitamina C, frutas y verduras puede
disminuirlo.
La ingesta de alcohol no parece un factor de riesgo ni tampoco las bebidas cafeínicas.
Otros factores favorecedores menos importantes son la historia de gastrectomía
y/o colecistectomía previas y la infección por Helicobacter pylori.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 14
3. BIOLOGÍA MOLECULAR Y CÁNCER DE PÁNCREAS
El páncreas es, esencialmente, un tejido quiescente en el que apenas hay proliferación
desde el punto de vista del ciclo celular, lo cual resulta importante para entender
cuáles son los mecanismos moleculares que operan durante la carcinogénesis.
El modelo que explica la progresión de un adenocarcinoma ductal pancreático es el
siguiente: a partir de células normales se producen lesiones hiperplásicas planas
(PanIN 1A) y otras papilares (PanIN 1B) sobre las que ocurren fenómenos de displasia
(PanIN 2) para progresar hasta lesiones de carcinoma in situ (PanIN 3)19. En estos
procesos se implican algunos genes clave, los más importantes son: k-ras, p16, p53 y
Smad4. Las alteraciones genéticas se encuentran en las células tumorales diluidas en
una masa de tejido normal, por lo que se dificulta la detección de las alteraciones
moleculares presentes en el tumor. Todas las rutas moleculares implicadas afectan de
forma crucial a la progresión G1-S.
El oncogén k-ras codifica para una proteína implicada en el crecimiento celular. En
más del 75% de los cánceres de páncreas se ha descrito una mutación puntual en
este gen que determina que la proteína esté siempre activa, llevando a las células a
una situación de proliferación y división descontroladas, propias del cáncer. Esta
alteración molecular se puede detectar ya en lesiones muy precursoras, lo cual hace
pensar que la activación de ras implica un papel iniciador en la tumorogénesis, pero no
es suficiente para desarrollar la neoplasia.
El gen supresor tumoral p53 desempeña un papel fundamental en la respuesta al
estrés celular, de forma que cuando éste amenaza la integridad del genoma celular, la
proteína p53 detiene el ciclo celular para intentar reparar el daño, y si no es posible,
conduce a la célula hacia muerte celular programada (apoptosis). Al menos en el 50-
70% de los tumores de páncreas la proteína p53 no es capaz de unirse al material
genético (ADN) para llevar a cabo su función. Las mutaciones pueden darse en
muchos lugares de la proteína (no puntuales) y se asocian con lesiones pancreáticas
ya avanzadas.
El gen supresor tumoral p16 codifica proteínas implicadas en el avance del ciclo
celular. Su mutación, presente en el 100% de los tumores de páncreas, ejerce un
papel importante en la progresión tumoral, desregulando el ciclo.
El gen Smad4 es un regulador transcripcional perteneciente a la familia de genes
Smad, que codifican para proteínas implicadas en la señalización por TGF-B. Su
mutación (50%) puede participar en fenónemos de progresión tumoral.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 15
Además de estas alteraciones genéticas, entre otras, los tumores de páncreas son
extremadamente aneuploides y, por tanto, muestran una gran variedad de ganancias,
pérdidas y reordenamientos cromosómicos. También existen cambios en el
funcionamiento del genoma no asociados a cambios de secuencia ADN (epigenética).
4. CLASIFICACIÓN DE LOS TUMORES PANCREÁTICOS
Los tumores pancreáticos pueden ser primitivos o metastáticos.
Los primitivos pueden originarse tanto en el tejido pancreático exocrino (conductos y
células acínares) como en el endocrino (islotes) y el tejido conectivo. Los tumores
benignos más frecuentes son los de los islotes y el cistoadenoma. En cambio, los
adenomas ductales y acinares, así como los tumores benignos del tejido conectivo,
son extremadamente raros.
La gran mayoría de los tumores malignos son carcinomas ductales. Su tipo
anatomopatologico más común, el adenocarcinoma, es un tumor de gran agresividad
biológica, y por ello el pronóstico del cáncer pancreático, considerado globalmente, es
muy desalentador. Sin embargo, otros tumores pancreáticos malignos, de origen
ductal o extraductal, tienen un pronóstico muy favorable cuando son extirpados
quirúrgicamente. También es favorable el pronóstico de los tumores periampulares no
pancreáticos, un conjunto de tumores que pueden ser difíciles de diferenciar en el
preoperatorio del adenocarcinoma de páncreas. Por lo tanto, el diagnóstico genérico
de cáncer pancreático no debe conducir a posturas terapéuticas nihilistas.
El pronóstico de los tumores pancreáticos malignos primitivos depende estrictamente
de su tipo anatomopatologico, y a menudo éste sólo puede ser identificado después de
la extirpación quirúrgica.
Clasificación anatomopatológica de los tumores panc reáticos
Tumores de la porción
exocrina del páncreas
Tumores del páncreas
endocrino
Tumores no epiteliales
del páncreas
Adenocarcinomas
Carcinomas escamosos
Carcinomas pleomórficos
Carcinomas mucinosos
Carcinomas microcíticos
Tipo osteoclásticos
Microadenocarcinomas
Insulinomas
Glucagonomas
Somatostatinomas
VIPomas
PPomas
Linfomas
Sarcomas

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 16
Clasificación anatomopatológica de los tumores prim itivos del páncreas
Origen Benignos Malignos
Epitelio de los
conductos pancreáticos
Adenoma tubular
Adenoma velloso
Adenocarcinoma ductal
Microadenocarcinoma
Carcinoma adenoescamoso
Carcinoma oncocítico
Carcinoma coloide
Carcinoma de células en avena
Carcinoma de células ciliadas
Carcinoma de células gigantes
Tumor papilar sólido quístico
Carcinoide
Cistoadenocarcinoma
Células acinares Adenoma
Cistoadenoma
Carcinoma de células acinares
Cistoadenocarcinoma acinar
Células de
los islotes
Adenoma
Cistoadenoma
Carcinoma neuroendocrino
Cistoadenocarcinoma
neuroendocrino
Tipo celular mixto
(ductal e insular)
Adenoma Carcinoma
Tejido conectivo Lipoma, mioma, fibroma,
neurinoma,
hemangioma,
linfangioma
Liposarcoma, leiomiosarcoma,
fibrosarcoma, neurinoma maligno,
hemangiopericitoma maligno,
linfangioma maligno
Tejido incierto Pancreaticoblastoma
Tejido linfoide Linfoma
La mayoría de los tumores pancreáticos metastáticos son por lo general hallazgos en
pacientes fallecidos por carcinomatosis generalizada. Los órganos que con mayor
frecuencia originan las metástasis son la mama, pulmón, colon, estómago y piel
(melanoma).

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 17
5. CARCINOMA DUCTAL: ADENOCARCINOMA
Definición. En sentido estricto, el término carcinoma ductal comprende a todos los
tumores malignos originados en células de los conductos pancreáticos. En la práctica,
carcinoma ductal es sinónimo de adenocarcinoma, que es su tipo anatomopatologico
más frecuente (más del 70 % de los casos). El significado clínico de los restantes tipos
anatomopatológicos del carcinoma ductal es muy diverso. Algunos de ellos (carcinoma
adenoescamoso, de células gigantes, oncocítico, microadenocarcinoma) son por su
aspecto macroscópico y pronóstico muy similares al adenocarcinoma. Otros, en
cambio (cistoadenocarcinoma, carcinoide, tumor papilar quístico), no son
habitualmente considerados carcinomas ductales debido a sus especiales
características morfológicas y a su pronóstico mucho más favorable (véase tumores
quísticos y tumores endocrinos).
En el presente capítulo, el término carcinoma ductal designa al adenocarcinoma y
otras variantes anatomopatológicas de pronóstico similar.
Patogenia. Investigaciones recientes han comenzado a dilucidar las bases genéticas
del carcinoma ductal. Al igual que en el carcinoma de colon, se ha observado una
elevada frecuencia de mutaciones del oncogén K-ras en lesiones precursoras
neoplásicas, tales como las hiperplasias papilares o mucinosas de los conductos
pancreáticos. En el carcinoma ductal, la frecuencia de mutaciones del K-ras se eleva
hasta cifras nunca halladas en otros tumores. También se han observado mutaciones
en los genes supresores de actividad tumoral p53 y MTS1.
Anatomía patológica. El 65 % de los carcinomas ductales se localizan en la cabeza
del páncreas (cefálicos) y el 35 % restante en el cuerpo o cola. Parecen existir
diferencias biológicas entre ambas localizaciones. Según Cubilla y Fitzgerald (1987),
los tumores cefálicos son menos agresivos que los de cuerpo y cola. Estos últimos se
comportan frecuentemente como tumores ocultos, es decir, tumores pequeños que se
diagnostican por sus metástasis alejadas. De cualquier manera, todo adenocarcinoma
de páncreas es naturalmente invasor, lo cual se demuestra por la constante invasión
perineural (90 % de los casos), ganglionar (70 a 80 %) y venosa (50 %). En el
momento del diagnóstico, sólo 6 a 10 % de los carcinomas ductales cefálicos están
limitados al páncreas y no presentan metástasis ganglionares ni alejadas. En los del
cuerpo y cola esta cifra es inferior al 2 %.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 18
CARCINOMA DUCTAL CEFÁLICO Y OTROS TUMORES PERIAMPUL ARES
Por su sitio de origen, el carcinoma ductal cefálico integra el grupo de los llamados
tumores de la región periampular.
Este grupo comprende los tumores originados en la papila y tejidos adyacentes, como
la cabeza del páncreas, la vía biliar distal y el duodeno yuxtapapilar. Todos ellos
comparten características anatomopatológicas, clínicas y terapéuticas.
En primer lugar, el adenocarcinoma es el tipo anatomopatológico más frecuente de
todos los tumores periampulares.
Por este motivo, la diferenciación preoperatoria puede ser difícil; y aun el patólogo,
durante el examen de la pieza de resección quirúrgica, puede hallar dificultades para
determinar con precisión el origen del tumor. En segundo lugar, la proximidad de estos
tumores a la vía biliar hace que la ictericia obstructiva sea en todos un signo frecuente
y a menudo temprano. Finalmente, el tratamiento común a todos los tumores
periampulares resecables es la duodenopancreatectomía cefálica.
Fig. Tumores malignos periampulares: carcinoma de papila (/); carcinoma de duodeno
yuxtapapilar (2); carcinoma de la vía biliar distal (i); carcinoma de páncreas (4).
El carcinoma ductal pancreático es el tumor periampular más frecuente (80 % de los
casos), seguido por el de papila (15 %), vía biliar distal (3 %) y duodeno (3 %). El 50 %
de los carcinomas de la papila se proyectan dentro de la luz duodenal (extrapapilares)
y el 50 % restante hacia la vía biliar (intrapapilares).

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 19
6. PRESENTACIÓN CLÍNICA
En el 70 al 80 % de los tumores periampulares, el signo que motiva la consulta es la
ictericia. Por lo general se trata de una ictericia indolora, aunque no es infrecuente que
el enfermo refiera malestar o dolorimiento supraumbilical, e incluso dolor intenso
cuando existe colangitis. La ictericia asociada con vesícula palpable (signo de Bard y
Pic) ocurre en menos del 30 % de los casos y además no es específica, ya que puede
ser también hallada en las obstrucciones litiásicas agudas de la papila. La ictericia
intermitente, secundaria a la descompresión espontánea de la vía biliar, es un signo
que puede ser observado en los carcinomas de papila. Ha sido atribuido a necrosis
parcial del tumor o a fenómenos inflamatorios peritumorales. En cambio, la obstrucción
biliar por carcinoma de páncreas es rápidamente progresiva e irreversible.
La anorexia y la pérdida marcada de peso no son signos frecuentes de los tumores
periampulares, por lo que su presencia debe hacer sospechar una propagación
extrapancreática del tumor. Muy ocasionalmente, el motivo de consulta es una
hemorragia digestiva. Sus causas más frecuentes son la ulceración de un tumor de
papila o la perforación hacia la luz del duodeno de un carcinoma pancreático.
Dolor
La mayoría de los pacientes (90%) presentan dolor en el transcurso de la
enfermedad8. En el 80% el dolor es el síntoma de inicio. Suele ser constante,
localizado en la región epigástrica y en ambos hipocondrios y generalmente es
transfixiante hacia la región dorsolumbar. Es de predominio nocturno, impide el sueño,
empeora después de la ingesta y también en la posición de decúbito supino. Alivia al
sentarse y al flexionar el cuerpo hacia delante. El dolor se debe a invasión
carcinomatosa del tejido perineural y a la compresión mecánica de estructuras
vecinas. El dolor que aparece en los períodos postingesta puede estar ocasionado por
un aumento de la presión secretora ductal como consecuencia de la obstrucción total o
parcial del conducto pancreático por el propio tumor.
Ictericia
Está presente en gran parte de los pacientes y se debe, en los tumores localizados en
la cabeza, a obstrucción de la vía biliar al quedar ésta englobada por el propio tumor.
En los tumores de cuerpo y cola es menos frecuente y aparece como consecuencia de
la invasión metastásica del hígado.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 20
Pérdida de peso
Es un hallazgo frecuente, debido sobre todo a la disminución del aporte calórico. Otro
factor implicado es la diarrea con esteatorrea como consecuencia de la malabsorción
motivada por la obstrucción tumoral del conducto de Wirsung, con disminución de la
secreción de bicarbonato y enzimas.
7. DIAGNÓSTICO
� Laboratorio
Es frecuente la hiperbilirrubinemia de instalación rápida y superior a 15 mg%. Cuando
no existe hiperbilirrubinemia, es común hallar niveles elevados de fosfatasa alcalina y
de y-glutamiltranspeptidasa, lo cual revela obstrucción, al menos parcial, de la vía
biliar. También es frecuente hallar una anemia moderada; de hecho, en el 90 % de los
tumores periampulares el examen de sangre oculta en la materia fecal es positivo.
Diversos marcadores tumorales han sido ensayados para el diagnóstico y pronóstico
del carcinoma ductal de páncreas.
Los más utilizados actualmente son los antígenos CA19-9,
DUPAN-2, SPAN-1, CA-242 y CA-494. Dado que su positividad depende del volumen
tumoral, no es de extrañar que la sensibilidad de los antígenos sea baja cuando se
trata de tumores pequeños. Por otra parte, no son específicos, ya que son frecuentes
los falsos positivos en la inflamación pancreática aguda o crónica y en otros tumores
del aparato digestivo. El valor actual de estos marcadores es sobre todo pronóstico
debido a su capacidad para identificar la enfermedad avanzada y la recidiva tumoral.
Marcadores Tumorales
Ninguno de los actuales marcadores tumorales séricos disponibles –antígeno
carcinoembrionario (CEA), CA 19.9, CA 125, CA 50, DU-PAN-2, SPAN-1, elastasa
inmunorreactiva, etc. – es suficientemente sensible y específico como para ser
utilizado de forma sistemática en el diagnóstico.
El CA 19.9 es uno de los marcadores que ha despertado mayor interés. Es un
antígeno identificado mediante el anticuerpo monoclonal de ratón 116NS 19-9 (IgGI)
asociado a tumor, sintetizado por las células ductales pancreáticas y biliares y por los
epitelios gástrico, colónico, endometrial y salival. El determinante antigénico es la
sialosil-fucosil-lactotetrosa, un oligosacárido vinculado al grupo sanguíneo Lewis A. Su
sensibilidad se incrementa al aumentar el tamaño del tumor y también en estadios
avanzados. Uno de sus inconvenientes radica en que niveles elevados de CA 19.9

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 21
pueden hallarse en la ictericia obstructiva benigna, en la colangitis o en episodios de
pancreatitis aguda.
Su mayor utilidad se obtiene cuando se usa como complemento de otras técnicas
diagnósticas y también en la detección precoz de una recidiva tumoral en los
carcinomas que antes de su resección tienen niveles séricos de CA 19,9 elevados y
que descienden a la normalidad en el postoperatorio inmediato o durante tratamientos
citostáticos activos.
El CEA es el marcador de referencia para el cáncer gastrointestinal. Se encuentran
niveles séricos elevados en pacientes, con diversos tumores y también en cáncer de
páncreas, si bien cuando esto ocurre es en enfermedad avanzada.
Radiología convencional. La seriada gastroduodenal y la duodenografía hipotónica
no tienen actualmente indicación alguna en el diagnóstico de los tumores
periampulares. En cambio, la radiografía simple de tórax es imprescindible para
investigar eventuales metástasis pulmonares.
� Diagnóstico por imagen.
La ecografía y la tomografía computada son métodos imprescindibles ante la
sospecha de un tumor periampular. La resonancia nuclear magnética no ha superado
a la tomografía, y por lo tanto, su empleo no está por el momento justificado. La
identificación mediante ecografía o tomografía de una masa periampular bien definida
simplifica notablemente el manejo preoperatorio. En esta situación clínica, la
opacificación preoperatoria de la vía biliar principal o del conducto de Wirsung es
innecesaria ya que poco aporta al diagnóstico diferencial y no modifica la indicación
quirúrgica. Por otra parte, el cirujano dispone de la colangiografía operatoria y
eventualmente de la coledoscopia.
Para ser detectada por ecografía o tomografía computada, la masa periampular debe
medir 1,5 cm o más. Por esta razón, buen número de carcinomas de la papila y de la
vía biliar, así como algunos carcinomas pancreáticos, no presentan masa idenlificable
y deben sospecharse a partir de la dilatación secundaria de la vía biliar o del conducto
de Wirsung.
Ecografía. Ha de ser el estudio inicial en pacientes que presentan ictericia.
La detección de dilatación biliar y/o la presencia de una masa pancreática sugiere la
existencia de un tumor subyacente.
Su sensibilidad y especificidad alcanzan el 75-90% y 90- 99% respectivamente,
aunque estos datos dependen, obviamente, de la experiencia del radiólogo.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 22
Tomografía computarizada con contraste. Es útil para identificar la masa tumoral,
especialmente en los casos en los que no hay un comienzo ictérico, así como para
valorar la presencia de metástasis hepáticas. La afectación vascular mesentérica
superior, de la vena porta y arterias celíaca y mesentérica superior también pueden
ser identificadas para valorar la opción quirúrgica. Respecto a la ultrasonografía tiene
mejor sensibilidad (85-90%) y similar especificidad.
Aquellos pacientes con datos en la tomografía computarizada (TC) indicativos, pero no
diagnósticos, de invasión vascular pueden beneficiarse de angiografía visceral
perioperatoria, aunque los escáneres de última generación con empleo de técnicas
dinámicas de perfusión de contraste y helicoidales han suplantado mayoritariamente a
esta técnica.
Resonancia magnética. No ha demostrado ser superior a la TC para la valoración del
tumor primario, invasión vascular ni enfermedad a distancia.
Tomografía por emisión de positrones. No ha demostrado utilidad en el diagnóstico
ni en la estadificación del cáncer de páncreas. La esperanza inicial de que esta prueba
permitiera distinguir pancreatitis crónica de pro procesos neoplásicos no ha sido
confirmada en estudios clínicos y, además, no detecta un número importante de
metástasis ganglionares linfáticas ni peritoneales. Ante la insuficiencia de datos, y
debido al alto coste y disponibilidad limitada, la tomografía por emisión de positrones
(PET) no está validada en la actualidad en el apartado del cáncer de páncreas.
Colangiopancreatografía retrógrada endoscópica. Los pacientes con ictericia, pero
sin masa por TC, se evalúan por este método, que consiste en la visión directa
endoscópica de la vía bilio-pancreática a través del tubo digestivo. Ésta puede revelar
una estenosis biliar irregular o adelgazada característica de un tumor periampular
obstructivo. En ocasiones se observa una estenosis biliar junto con estenosis del
conducto pancreático (signo del doble conducto), que resulta muy indicativa de
neoplasia pancreática. Los cepillados y biopsias endoscópicas pueden confirmar la
presencia de una neoplasia pancreática, aunque tiene una tasa relativamente elevada
de falsos positivos.
Ecografía endoscópica. Valora el tamaño tumoral, siendo especialmente útil en los
casos de tumores pequeños (menos de 2-3 cm), la afectación vascular portal y
mesentérica y la afectación ganglionar regional. Además permite la obtención de

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 23
muestras para análisis histológico de todas las lesiones pancreáticas y ganglios
linfáticos sospechosos localizados próximos al estómago y al duodeno. La calidad de
la información clínica depende de la experiencia del especialista. Esta técnica ha sido
estudiada con resultados variables para el diagnóstico y estadificación del cáncer
pancreático comparada con otras más clásicas, encontrando resultados variables.
� Diagnóstico histológico
Biopsia percutánea. Puede utilizarse guiada por TC o ecografía. La sensibilidad y
especificidad alcanzadas dependen del tamaño tumoral y experiencia del patólogo,
pero varía entre el 80-90% y 98- 100%14. Uno de los principales problemas que ha
representado esta técnica clásicamente es la probabilidad de diseminación peritoneal
en pacientes que pudieran ser candidatos a resección curativa, y aunque algunos
estudios sugieren que el riesgo es nulo, en la práctica clínica se tiende a evitar esta
técnica.
Biopsia por ecografía endoscópica. Tiene una sensibilidad del 85-90% y una
especificidad del 100%, Es más segura que la anterior, por lo que se está utilizando
cada vez con más frecuencia en pacientes, incluidos aquellos candidatos a cirugía, ya
que la diseminación peritoneal del material aspirado no tiene lugar.
Laparoscopia diagnóstica con toma de biopsias. Permite evaluar las superficies
viscerales y peritoneales y así demostrar afectación indetectable por otras técnicas.
Esto supone un avance significativo en la estadificación preoperatoria de los pacientes
con cáncer pancreático y otros tumores periampulares, ya que entre los casos
potencialemente resecables se ha observado una incidencia de enfermedad
localmente avanzada o pequeños implantes peritoneales del 20- 30%, que anulan las
posibilidades de cirugía.
Esta técnica puede llevarse a cabo en 15 a 20 minutos y seguirse de una laparotomía
formal y resección del tumor en el mismo acto quirúrgico si procede. Los datos
disponibles indican que esta técnica reduce la incidencia de enfermedad irresecable
en el momento de la laparotomía en más de un
50%.
Los lavados peritoneales obtenidos en la laparoscopia son importantes desde el
punto de vista pronóstico. Aunque se podría intuir que aquellos pacientes con citología
de lavado positiva no se benefician de cirugía de tumor primario, no está demostrado
que este hecho aislado impacte negativamente en la supervivencia16. En general

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 24
estos casos presentan en el momento de la laparoscopia otros hallazgos que sugieren
enfermedad avanzada, como enfermedad hepática, ascitis o carcinomatosis
peritoneal. En caso contrario, la mayoría de los cirujanos optan por procedimientos
quirúrgicos agresivos del cáncer primario.
8. DIAGNÓSTICO DIFERENCIAL
Cuando el síntoma predominante es el dolor, la pancreatitis crónica es la entidad que
mayor dificultad plantea en el diagnóstico diferencial. La pancreatitis crónica suele
afectar a pacientes de menor edad, que por regla general han abusado del consumo
de alcohol y en los que con frecuencia se detectan calcificaciones pancreáticas.
Existen otros datos indirectos que nos pueden ayudar a diferenciar ambas entidades;
sin embargo, hay que saber que ambos cuadros pueden llegar a ser tan similares uno
al otro que sólo el análisis histológico los diferencian.
Otras entidades que cursan con sintomatología dolorosa similar a la del cáncer son
diversos tumores intraabdominales no pancreáticos (linfoma, carcinoma gástrico e
intestinal, etc.) e incluso algunas afecciones benignas, como la úlcera gastroduodenal.
Cuando la forma de presentación es una ictericia indolora, ésta debe diferenciarse en
primer lugar de una ictericia por obstrucción biliar benigna (colelitiasis), que suelen
cursar con episodios de dolor cólico. En segundo lugar, debe diferenciarse de una
ictericia por enfermedad parenquimatosa hepática. La observación de la vía biliar
mediante alguno de los métodos de diagnóstico descritos ayudará en el diagnóstico
diferencial.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 25
Diagnóstico diferencial entre pancreatitis crónica y cáncer de páncreas
Pancreatitis crónica
Cáncer de páncreas
Epidemiología
- Antecedente de etilismo
- Crisis previas de pancreatitis
aguda
- Hiperlipidemia
- Hiperparatiroidismo
- Mayor incidencia después
de los 60 años
- Diabetes
- Tabaco
Clínica
- Dolor en cinturón se relaciona
con la ingesta
- Diarrea-esteatorrea
- Pérdida de peso por miedo a
comer
- Dispepsia intercrisis
- Dolor visceral profundo
continuo persistente y
progresivo
- Dispepsia postingesta
- Síndrome constitucional
Pruebas
complementarias
- Calcificaciones en la radiología
simple en un 60% de los casos
- Páncreas disminuido de tamaño
- Estenosis difusa de Wirsung
- Son raras las calcificaciones
- Aparece masa pancreática
en el 80% de los tumores
- Estenosis localizada del
Wirsung
- Elevación de marcadores
Ca 19.9 y Ca 50
9. FACTORES PRONÓSTICOS
El conocimiento de los factores pronósticos del CP es necesario para la correcta
selección del tratamiento multidisciplinario, con el fin de obtener el mejor beneficio
curativo y/o paliativo con la menor morbimortalidad. Además nos ayudan a predecir la
evolución clínica y supervivencia, así como a estratificar a los pacientes en subgrupos
para evaluar comparativamente la eficacia de los distintos tratamientos.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 26
a) Factores pronósticos dependientes del tumor
Resecabilidad
Es el factor pronóstico de supervivencia más importante, ya que el único tratamiento
potencialmente curativo es el quirúrgico.
Anatomopatológicos
Los caracteres tumorales con mayor fuerza pronóstica son los siguientes:
1. Tamaño tumoral. Aquellos tumores menores de 2 cm presentan supervivencias más
favorables.
2. Afectación de los márgenes de resección.
3. Afectación ganglionar linfática.
4. Invasión vascular, perineural y linfática.
5. Grado de diferenciación. Sólo algunos autores han evidenciado influencia
significativa del grado de diferenciación en el pronóstico.
6. Contenido de ADN nuclear. Algunos trabajos asocian la aneuploidia con una peor
diferenciación histológica, con la presencia de metástasis al diagnóstico y con una
peor supervivencia.
7. Histología. El cistoadenocarcinoma es la variante histológica de mejor pronóstico,
pero por desgracia, es mucho menos frecuente que el adenocarcinoma.
Marcadores serológicos
Niveles muy altos de CA 19.9 orientan habitualmente a la irresecabilidad. Además este
marcador tumoral es un indicador fiable de respuesta al tratamiento con QT y
RT y es extremadamente útil en el seguimiento, ya que su elevación puede anteceder
a la aparición de una recaída.
Marcadores moleculares
En los últimos años se han identificado múltiples alteraciones moleculares en el CP, y
aunque en la mayoría se desconoce su valor pronóstico, la mayoría de los autores
coinciden en que la mutación de p53 es un factor pronóstico adverso independiente.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 27
b) Factores pronósticos dependientes del paciente
La ictericia y el dolor son los síntomas más frecuentes en el CP, y ambos se
relacionan con el pronóstico. La ictericia suele ser un síntoma precoz en los tumores
ubicados en la cabeza del páncreas, por lo que son diagnosticados en estadios
iniciales, lográndose la resección quirúrgica en un alto porcentaje. En los tumores de
cuerpo-cola, la ictericia suele ser secundaria a metástasis ganglionares con
obstrucción de la vía biliar o metástasis hepáticas, definiéndose la enfermedad como
diseminada e irresecable. La presencia de dolor se asocia con más frecuencia a
tumores irresecables (80%) o metastásico (85%) que a resecables, apareciendo sólo
en un tercio de estos últimos.
Así mismo, el estado general y la pérdida de peso superior al 10% son factores
pronósticos establecidos, mientras que la edad y el sexo no parecen influir en la
supervivencia.
c) Factores pronósticos dependientes del tratamient o
Como hemos indicado anteriormente, la resecabilidad quirúrgica es el factor pronóstico
más importante. En cuanto a la influencia del tratamiento con QT y/o RT en la
supervivencia del CP, existen multitud de estudios aleatorizados, pero sus resultados
serán analizados en otro apartado de este capítulo.
10. ESTADIAJE
La estadificación de los tumores de páncreas es fundamental para conocer el
pronóstico del enfermo y la estrategia terapéutica indicada. La clasificación
internacionalmente más utilizada es la TMN, donde T representa el tamaño tumoral
primario y la afectación de estructuras locales, N la afectación ganglionar regional y M
la presencia de enfermedad a distancia.
Los tumores estadio I están limitados al páncreas. Los tumores estadio II son
regionalmente invasores sin afectación de grandes vasos, aunque pueden
comprometer ganglios linfáticos regionales. Las lesiones en estadio III se definen por
afectación regional de grandes vasos y en estadio IV cuando ya existen metástasis a
distancia.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 28
Clasificación TNM y estadificación del cáncer de pá ncreas
T: Tumor primario
TX: No se puede evaluar el tumor primario
T0: No existen signos de tumor primario
Tis: Carcinoma in situ
T1: Tumor ≤ 2 cm de diámetro mayor limitado a páncreas
T2: Tumor > 2 cm de diámetro mayor limitado a páncreas
T3: Se extiende fuera del páncreas pero no compromete el tronco celiaco ni la
arteria mesentérica superior
T4: Compromete el tronco celiaco o la arteria mesentérica superior
N: Ganglios linfáticos regionales
Nx: No se pueden evaluar
N0:No se demuestran metástasis ganglionares
N1: metástasis ganglionares regionales
M: Presencia de metástasis a distancia
Mx: No se pueden evaluar
M0: No hay metástasis
M1: Presencia de metástasis a distancia
Estadios
Estadio 0: TisN0M0
Estadio IA: T1N0M0
Estadio IB: T2N0M0
Estadio IIA: T3N0M0
Estadio IIB: T1-3N1M0
Estadio III: T4 cualquier N, M0
Estadio IV: Cualquier T, cualquier N, M1b

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 29
11. TRATAMIENTO
El único tratamiento potencialmente curativo de los tumores malignos periampulares
es la cirugía. Una correcta estadificación preoperatoria permite preparar
adecuadamente al enfermo que requiere cirugía mayor y evitar la cirugía en caso de
enfermedad avanzada y corta expectativa de vida.
Estadificación preoperatoria. Se basa habitualmente en la determinación del estadio
evolutivo mediante la ecografía y la tomografía computada, y la evaluación clínica del
riesgo quirúrgico. Los pacientes así estadificados pueden ser separados en tres
grupos.
Grupo I: Comprende a los enfermos con un tumor aparentemente resecable por su
grado de extensión local, sin metástasis alejadas ni ascitis, y que presentan un riesgo
quirúrgico aceptable para un procedimiento quirúrgico mayor. Estos pacientes son
candidatos a la cirugía con propósito curativo (duodenopancreatectomía cefálica).
Grupo II: Comprende los enfermos sin metástasis alejadas ni ascitis, pero con
evidencias en los métodos por imágenes de que el tumor es irresecable (invasión de
planos grasos y de la vena porta, hipertensión portal). Pese a la irresecabilidad del
tumor, la cirugía está por lo general indicada para paliar la ictericia y eventualmente
una obstrucción duodenal. Si bien la colocación de una endoprótesis por vía
endoscópica es otra alternativa válida para aliviar la ictericia, la corta permeabilidad de
la endoprótesis (menos de 4 meses) contrasta con la sobrevida promedio de los
pacientes de este grupo (más de 9 meses). Por su efecto paliativo mucho más
prolongado, la anastomosis biliodigestiva quirúrgica sigue siendo la mejor opción en
estos casos.
Grupo III: Comprende a los enfermos con metástasis alejadas o ascitis, y por ende,
una expectativa de vida que no supera los 4 meses. Todo procedimiento quirúrgico
está contraindicado y la colocación de una endoprótesis endoscópica es la mejor
opción.
Métodos complementarios de estadificación preoperatoria.
Tanto la ecoendoscopia como la laparoscopia han demostrado recientemente que
pueden mejorar la estadificación preoperatoria. La ecoendoscopia es más sensible
que la ecografía, y quizás también que la tomografía computada, para detectar la

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 30
extensión del carcinoma a la vena porta. Por su parte, la laparoscopia parece ser más
sensible que la ecografía y la tomografía computada para detectar metástasis
hepáticas y peritoneales. Por su reciente introducción, el rol definitivo de ambos
métodos no ha sido aún establecido.
a) Tumor resecable
Estos tumores constituyen la gran posibilidad terapéutica del cáncer de páncreas en la
actualidad. Destaca por su importancia la cirugía curativa y también se consideran
otras posibilidades de tratamiento adyuvantes.
CIRUGÍA CURATIVA
La intervención quirúrgica de elección en el adenocarcinoma de la cabeza pancreática
localizado es la pancreatoduodenectomía ampliada, que consta de 6 etapas
claramente definidas seguidas de 4 de reconstrucción y difiere de la
pancreatoduodenectomía estándar o intervención de Whipple en 3 aspectos:
1. Técnica ampliada de Kocher: es la maniobra de resección del tejido linfático por
encima del riñón izquierdo, vena cava inferior y vena renal inferior.
2. Disección retroperitoneal mediante la eliminación de todo el tejido a la derecha de la
AMS y ligadura de la arteria pancreatoduodenal izquierda.
3. Resección venosa segmentaria en los pacientes con infiltración tumoral de la vena
mesentérica superior o de la confluencia VMSP.
Estos 3 aspectos de ampliación a la pancreatoduodenectomía estándar se
fundamentan en la alta incidencia de afectación metastásica a estos niveles, lo que
conlleva un mejor control locorregional y probablemente un incremento en la
supervivencia.
Los recientes avances en las técnicas quirúrgicas, anestésicas y cuidados intensivos,
así como la mejor selección de los pacientes que cumplen los criterios de
resecabilidad, han permitido que la mortalidad operatoria actual sea inferior al 5%.
Las hemorragias, la sepsis abdominal y lasfístulas pancreáticas son las causas de
mortalidad más frecuentes tras la intervención quirúrgica.
Solamente cuando la resección tumoral es completa y los márgenes quirúrgicos son
negativos se obtiene un beneficio en la supervivencia. De los pacientes sometidos a
laparotomía con intención curativa (por cumplir criterios de resecabilidad por TAC)
únicamente en el 16% al 30% se consigue una resección satisfactoria, ya que en el

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 31
resto se evidencian metástasis hepáticas o peritoneales e invasión de la AMS
inapreciables previamente en la TAC.
Etapas de la cirugía curativa del cáncer de páncrea s
A. Pancretoduodenectomia ampliada
1. Técnica Cattel-Braasch exponiendo la VMS
2. Técnica ampliada de Kocher
3. Disección portal
4. Sección transversal del estómago
5. Sección transversal del yeyuno y disección del ligamento de Treitz, rotando el
duodeno bajo los vasos mesentéricos
6. Resección transversal del páncreas y completa disección retroperitoneal resecando
el tumor desde la AMS
B. Reconstrucción tras la pancreatoduodenectomía
1. Pancreatoyeyunostomía terminolateral
2. Coledocoyeyunostomía terminolateral
3. Gastroyeyunostomía (antecólica) terminolateral
4. Tubo de gastrostomía. Tubo de yeyunostomía. Drenajes
Medidas terapéuticas preoperatorias.
Además de las medidas preoperatorias habituales a toda intervención quirúrgica
mayor, la cirugía del carcinoma periampular puede requerir medidas preoperatorias
especiales. La presencia de coagulopatía, insuficiencia renal o colangitis aguda, todas

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 32
ellas complicaciones eventuales de la obstrucción biliar, contraindican la resección
pancreática. La administración parenteral de vitamina K, el manejo adecuado del
medio interno y el empleo de antibióticos permiten controlar a menudo esas
complicaciones y restablecer una condición preoperatoria aceptable. En caso
contrario, es imprescindible descomprimir preoperatoriamente la vía biliar mediante el
drenaje endoscópico. o si éste no fuera posible, el drenaje transparietohepático. Una
vez normalizadas la coagulación y la función renal, y desaparecida la colangitis, el
enfermo puede ser operado con intención curativa.
Procedimientos quirúrgicos
Duodenopancreatectomía cefálica. Es el procedimiento de elección para todos los
tumores malignos periampulares resecables (Grupo I de la estadificación
preoperatoria). Consiste en la extirpación en bloque del duodeno, cabeza y gancho del
páncreas, vía biliar principal incluyendo la vesícula, primeros 40 cm del yeyuno y
ganglios regionales correspondientes. La sección proximal del tubo digestivo se realiza
por encima del antro gástrico (duodenopancreatectomía convencional) o por debajo
del píloro (duodenopancreatectomía con conservación del píloro). La reconstrucción
incluye la hepaticoyeyunoanastomosis, la pancreaticoyeyunoanastomosis, y según el
nivel de sección del tubo digestivo, la gastroenteroanastomosis o la
duodenoyeyunoanastomosis.
Morbimortalidad operatoria. La duodenopancreatectomía cefálica es una de las
técnicas más complejas de la cirugía abdominal y la de mayor morbimortalidad
postoperatoria, debido a la magnitud de la resección y a las múltiples anastomosis
involucradas. Su complicación más grave es la dehiscencia de la anastomosis
pancreaticoyeyunal. Ocurre en 10 a 20 % de los casos y puede ocasionar peritonitis,
abscesos, hemorragias e incluso la dehiscencia de anastomosis vecinas.
Para prevenir esta complicación se han ensayado otras técnicas, tales como la
anastomosis con el estómago (pancreatogastroanastomosis) y el cierre del muñón
pancreático sin anastomosis alguna. Ninguna ha demostrado ser la solución ideal,
aunque la pancreatogastroanastomosis puede ser considerada una alternativa válida.
En centros con gran experiencia en cirugía pancreática, la mortalidad de la
duodenopancreatectomía es actualmente inferior al 5 %. Esto contrasta con los
resultados de otros centros donde es rara vez ejecutada y la mortalidad supera el 20
%. La opinión que prevalece actualmente es que esta operación sólo debería
ejecutarse en aquellos centros que pueden ofrecer una morbimortalidad razonable.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 33
Fig. A, En rayado se aprecia el área que debe ser extirpada en la
duodenopancreatectomía cefálica. B, Órganos por reconstruir: vía biliar (1); páncreas
(2); estómago (3): intestino delgado (4). C. Reconstrucción digestiva;
hepaticoyeyunoanastomosis (1), pancreatoyeyunoanastomosis terminolateral
(2) con cierre del cabo intestinal (3), y gastroenteroanastornosis (4).

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 34
Fig. Duodenopancreatectomía cefálica con conservación de píloro y
duodenoyeyunoanastomosis (1).
Fig. Anastomosis del páncreas remanente con la cara posterior del estómago
(anastomosis pancreatogástrica; I).

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 35
Otros procedimientos
La duodenopancreatectomía extendida
Agrega sistemáticamente una extensa linfadenectomía retroperitoneal y
eventualmente la extirpación de un segmento de la vena porta cuando ésta se halla
infiltrada por el tumor.
La escuela japonesa sostiene que la linfadenectomía extensa. Por sí sola, mejora la
sobrevida de la enfermedad; sin embargo, esta hipótesis ha sido rechazada por otros
autores. Tampoco existen pruebas de que la extirpación del segmento infiltrado de la
vena porta mejore el pronóstico.
La duodenopancreatectomía total (incluyendo cuerpo y cola del páncreas) está
ocasionalmente indicada en tumores periampulares extensos o multicéntricos.
Finalmente, la extirpación de la papila o ampulectomía puede utilizarse en enfermos
con riesgo quirúrgico elevado y tumor limitado a la papila, sin infiltración de la cabeza
pancreática.
Tratamiento adyuvante
A pesar de la mayor selección radiológica de pacientes con tumor resecable, la
supervivencia a 5 años de los casos con cirugía satisfactoria sólo es del 5%- 25%.
Con el objetivo de incrementar esta última se han realizado múltiples ensayos fase
II y III añadiendo tratamiento complementario.
La mayoría de los oncólogos europeos consideran que aún no existen suficientes
datos de beneficio en la supervivencia con la terapia adyuvante, por lo que no
consideran este tratamiento estándar. Los resultados de ensayos actualmente en
marcha quizá nos indiquen lo contrario.
Tratamiento neoadyuvante
Otro de los planteamientos multidisciplinarios dirigido a incrementar la supervivencia
de los CP potencialmente resecables es la QT y RT concomitante neoadyuvante o
preoperatoria. Las ventajas de este procedimiento frente al adyuvante se basan en los
siguientes aspectos:

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 36
1. La RT es más efectiva frente a células tumorales bien oxigenadas que no han sido
devascularizadas por la cirugía.
2. Puede disminuir la alta frecuencia de resecciones con margen positivo.
3. Pueden prevenir la diseminación peritoneal provocada por la manipulación
quirúrgica
4. Se puede administrar en casi todos los pacientes, mientras que el tratamiento
adyuvante está restringido a pacientes sin postoperatorio tórpido.
5. Evita la laparotomía a los pacientes que evidencian metástasis a distancia tras el
tratamiento neoadyuvante (un 25% de los pacientes revelan metástasis hepáticas
radiológicas tras la terapia preoperatoria, que probablemente fuesen subclínicas al
diagnóstico y responsables de la progresión hepática inmediatamente después de la
cirugía).
Los estudios realizados con esta estrategia multidisciplinar reflejan un mejor control
locorregional en relación con la cirugía sola, pero no modifica significativamente las
recaídas a distancia ni la supervivencia.
Los estudios en marcha de neoadyuvancia con los nuevos QT activos en el CP,
algunos de ellos con propiedades radiosensibilizantes (por ejemplo, gemcitabina,
paclitaxel, etc.), parecen prometedores pero aún es pronto para definir conclusiones.
b) Tumor localmente avanzado irresecable
El 40% de los CP se presentan como tumores localmente avanzados sin metástasis a
distancia pero con criterios radiológicos de irresecabilidad. Tradicionalmente el
tratamiento aconsejado en estos casos era la RT paliativa. Actualmente, y sobre la
base de los resultados de estudios aleatorizados, se debe administrar tratamiento
combinado con RT y QT, ya que ofrece una supervivencia significativamente mejor
que cada uno de esos tratamientos por separado.
Pero este tratamiento combinado presenta
2 problemas importantes: primero su elevada toxicidad (principalmente digestiva) lo
que limita su aplicación sólo a pacientes con buen índice Karnofsky; y segundo, la
escasa eficacia de la QT a nivel sistémico (el 60% de los casos presentan progresión
en forma de metástasis hepáticas).
En los últimos años se están estudiando combinaciones de RT con nuevos QT (por
ejemplo gemcitabina, paclitaxel, etc.) pero hasta el momento sólo disponemos de
resultados preliminares de algún estudio fase I y escasos fase II.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 37
c) Tumor metastásico o recurrente
Objetivos
El objetivo fundamental de la QT en el CP metastásico o recurrente es el control de los
síntomas o el retraso de su aparición, por lo tanto es un tratamiento que debe
considerarse puramente paliativo.
Teniendo en cuenta que el factor pronóstico de respuesta a la QT más importante es
el estado general del paciente (índice de Karnofsky), ésta se debe ofrecer lo antes
posible en el curso de la enfermedad y principalmente en aquellos pacientes sin
ictericia u otros problemas adyacentes al CP que pueden incrementar los efectos
tóxicos de la QT (malabsorción, vómitos por estenosis pilórica o duodenal, caquexia,
etc.).
Quimioterapia y radioterapia. Hasta el presente, las experiencias con quimioterapia
en el tratamiento paliativo del carcinoma ductal no resecado han sido desalentadoras.
Ninguna droga o combinación de ellas ha demostrado aumentar significativamente la
supervivencia con respecto al grupo control.
En cambio, el empleo de la radioterapia combinada con quimioterapia, como
tratamiento adyuvante, parece promisorio.
En dos estudios, la administración de radioterapia y 5-fluoruracilo a enfermos
duodenopancreatectomizados y sin cáncer remanente duplicó la sobrevida del grupo
tratado con respecto al grupo control.
Monoquimioterapia
Hasta mediados de la década de los 90, la QT considerada más activa en el CP era la
que utilizaba 5-fluorouracilo (5FU), con un 15% de respuestas objetivas pero sin un
claro impacto en la supervivencia.
En los últimos años han aparecido nuevos quimioterápicos con actividad en el CP:
gemcitabina, paclitaxel, docetaxel, irinotecan, capecitabina, etc. De ellos, la
gemcitabina es el considerado más eficaz, tanto en respuestas objetivas como en
beneficio clínico (mantenimiento o ganancia de peso, mantenimiento o mejora del
estado general y disminución del dolor y de la necesidad de analgésico).
Un estudio aleatorizado ha comparado el efecto de la gemcitabina frente al 5FU en el
CP avanzado previamente no tratado.
Tanto la mediana de supervivencia (5,65 frente a 4,41 meses), como la supervivencia
a los 9 meses (24 frente a 6%) y el beneficio clínico (23,8 frente a 4,8%) fueron
significativamente mejores para los pacientes que habían recibido gemcitabina.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 38
Similares resultados se han objetivado en pacientes tratados con gemcitabina tras la
progresión a la terapia con 5FU.
Poliquimioterapia
Desde que en 1980 se publicaran los resultados del primer régimen de
poliquimioterapia utilizado en CP avanzado (esquema FAM : 5FU, adriamicina y
mitomicina) han aparecido multitud de esquemas combinando distintas QT (SMF:
estreptozotocina, mitomicina y 5FU; CAC: cisplatino, arabinósido de citosina y cafeína,
régimen de Mallison: 5FU, ciclofosfamida, metotrexate y vincristina con 5FU y
mitomicina de mantenimiento; CF: cisplatino y 5FU, etc). Ninguna de estas
combinaciones ha demostrado mayor eficacia frente a las otras ni incluso frente al 5FU
solo.
En relación con las combinaciones de nuevos quimioterápicos, parece que el 5FU con
gemcitabina, incrementa discretamente el número de respuestas objetivas y de la
mediana de supervivencia, por lo que actualmente es considerado el esquema
estándar en el CP avanzado.
Otras combinaciones con nuevos quimioterápicos (gemcitabina y docetaxel, 5FU y
oxaliplatino, gemcitabina e irinotecan, gemcitabina y capecitabina, etc.) parecen
prometedoras, aunque debemos esperar a las conclusiones de los estudios fase II en
marcha.
CIRUGÍA PALIATIVA: descompresión biliar
En la mayoría de los CP irresecables y/o metastásicos existe obstrucción de la vía
biliar extrahepática por el tumor, por lo que la primera medida paliativa es su
descompresión.
Tanto la derivación o by-pass quirúrgico como la colocación endoscópica o percutánea
de catéteres tipo stent son métodos efectivos para el alivio de la ictericia.
La preferencia de uno de estos métodos se debe realizar individualmente, basándose
fundamentalmente en el estado general del paciente y el volumen tumoral.
Los stent se obstruyen con mayor frecuencia pero presentan una morbilidad inicial
menor, estando indicados en pacientes con enfermedad avanzada y mal estado
general. En los casos con menor volumen tumoral y buen Karnofsky, en los que se
prevé una supervivencia más prolongada, se prefiere la realización de un by-pass
quirúrgico.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 39
La hepaticoyeyunoanastomosis con asa en Y de Roux y la
hepaticoduodenoanastomosis son las técnicas de elección para paliar la ictericia en
los enfermos del Grupo II de la estadificación preoperatoria. La
colecistoyeyunoanastomosis está contraindicada, ya que la obstrucción del conducto
cístico, por extensión del carcinoma, suprime la derivación biliar a través de la
anastomosis.
La gastroenteroanastomosis en la cara posterior del estómago, lejos del píloro, es la
técnica de elección para prevenir o tratar la obstrucción duodenal por extensión del
tumor.
Pronóstico
Para estadificar en el postoperatorio a los tumores periampulares según la
clasificación TNM se requiere un patólogo experimentado que determine exactamente
el origen de la neoplasia, su tamaño, extensión a tejidos vecinos, estado de los
ganglios e indemnidad de los márgenes de sección, en especial en el istmo y gancho
del páncreas y vía biliar proximal. Otros datos de valor pronóstico son el grado de
diferenciación histológica y el análisis citométrico del contenido en DNA de las células
tumorales.
En distintas series recientes, los factores de peor pronóstico en el carcinoma
pancreático resecado fueron un tamaño tumoral superior a 3 cm, la presencia de
cáncer en los márgenes de sección, la positividad de los ganglios regionales y la
aneuploidia del tumor en el análisis citométrico.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 40
Algoritmo diagnóstico-terapéutico del cáncer de pán creas

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 41
CARCINOMAS DUCTALES DEL CUERPO Y COLA
Presentación clínica
El síntoma más frecuente es el dolor, inicialmente leve y localizado en el epigastrio o
hipocondrio izquierdo, y más tardíamente irradiado al dorso.
La ictericia ocurre en menos del 20 % de los casos y puede ser secundaria a
metástasis hepáticas o a la extensión del tumor al colédoco intrapancreático. La
tromboflebitis de venas periféricas (signos de Trousseau) es un fenómeno
paraneoplásico mucho más frecuente en los carcinomas ductales de cuerpo y cola que
en los de cabeza.
Diagnóstico
Métodos por imágenes. El diagnóstico a menudo surge en una ecografía o
tomografía computada, indicadas por molestias inespecíficas o dolor abdominal
inexplicable. El tamaño del tumor oscila entre 2 y 6 cm y sus características
ecográficas o tomográficas no difieren de las descriptas en los carcinomas cefálicos.
Por lo general, la masa pancreática se asocia con frecuente la ascitis y la hipertensión
portal segmentaria por trombosis de la vena esplénica. Como ya se ha mencionado,
no es infrecuente que las metástasis se hagan evidentes antes que el tumor
(carcinoma oculto).
Pancreatografía endoscópica. Por lo general es innecesaria ya que la ecografía o la
tomografía son suficientes para el diagnóstico morfológico. En ocasiones debe ser
indicada ante masas pequeñas o mal definidas, no asociadas con metástasis.
Citología percutánea. Está indicada en todos los tumores que no van a ser
explorados, o sea, en más del 95 % de los casos. El propósito es confirmar el
diagnóstico, y por ende, descartar otros tumores primitivos o secundarios, de
pronóstico más favorable y que pueden presentar un aspecto similar en las imágenes
(linfoma, cistoadenocarcinoma sólido).

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 42
Tratamiento
En la casi totalidad de los carcinomas ductales de cuerpo y cola, el único tratamiento
posible es el bloqueo anestésico del esplácnico para paliar el dolor, que puede ser
intolerable. La laparotomía exploradora sólo debe ser indicada en pequeños
carcinomas, sin signos de irresecabilidad local ni de metástasis. El procedimiento
quirúrgico de elección en estos casos excepcionales es la esplenopancreatectomía
corporocaudal.
Pronóstico. Al año del diagnóstico, la sobrevida delcarcinoma ductal de cuerpo o cola
es inferior al 1 %, lo cual demuestra la agresividad fulminante de este tumor.
V. OTROS TUMORES DE PÁNCREAS EXOCRINOS
Carcinoma de células acinares
Es un tumor de consistencia blanda, bien delimitado, que suele afectar a pacientes
ancianos. Está constituido por nidos de células acinares. El citoplasma de éstas es
basófilo y contiene gránulos de cimógeno.
En ocasiones pueden hallarse niveles de lipasa sérica elevados y manifestaciones de
paniculitis no supurativa en extremidades y médula ósea, con presencia de nódulos
subcutáneos y poliartritis.
Pancreatoblastoma
Aparece casi exclusivamente en niños y puede alcanzar gran tamaño. La histología
muestra nidos sólidos que alternan con estructuras glandulares. En el centro de los
nidos se puede observar diferenciación escamosa. Se manifiesta por dolor abdominal
y la posible aparición de masa palpable. Tienen mejor pronóstico los encapsulados
que los no encapsulados, dado que éstos suelen extenderse a los órganos vecinos y
pueden recidivar tras resección y dar metástasis.
Carcinoma anaplásico o indiferenciado
Presenta tres formas histológicas: la pleomórfica, en la que predominan las células
gigantes tumorales con múltiples núcleos de aspecto abigarrado; la forma

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 43
sarcomatoide, con células fusiformes, y la forma de células pequeñas, que recuerda
recuerda al carcinoma tipo oat-cell de pulmón. El carcinoma anaplásico es el tumor
pancreático de peor pronóstico.
VI. TUMORES ENDOCRINOS
Definición. Son tumores benignos o malignos originados en células de los islotes de
Langerhans con capacidad para secretar hormonas específicas.
Clasificación. Existen cinco síndromes clínicos bien definidos, secundarios a tumores
de los islotes, que toman el nombre de la hormona que producen (tabla 39-7). Sin
embargo, el 30 al 40 % de los tumores que generan estas hormonas cursan sin el
síndrome, por lo cual son denominados no funcionantes.
Otros tumores secretan péptidos tales como neurotensina, bombesina, encefalinas y
polipéptido pancreático. Estos son siempre no funcionantes, debido a que tales
sustancias no determinan síndrome clínico alguno.
Tumores pancreáticos endocrinos
Tumor y
hormona
Síndrome clínico Porcentaje de
malignidad
Insulinoma
(insulina)
Confusión mental, alucinaciones.
convulsiones, hipoglucemia
10
Gastrinoma
(gastrina)
Enfermedad ulcerosa grave, diarrea
secretoria, hiperpotasemia
(síndrome de Zollinger y Ellison)
60
Glucagonoma
(glucagón)
Eritema necrolítico migratorio,
estomatitis, glositis, diabetes.
anemia normocrómica
90
Vipoma
(péptido vasointestinal)
Diarrea secretoria, hipopotasemia,
eritema cutáneo (síndrome de
Verner-Morrison)
50
Somatostatinoma
(somatostatina)
Esteatorrea, colelitiasis, diabetes 90

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 44
Anatomía patológica. Casi todas las hipótesis acerca del origen de los tumores
pancreáticos endocrinos se basan en alteraciones embrionarias. En 1968, Pearse
utilizó las siglas APUD (amine precursor uptake and decarboxylation) para describir las
células de estos tumores y atribuyó su origen a la cresta neural. Estudios más
recientes consideran que las células
APUD de la tiroides, médula adrenal, ganglios neurales y cuerpo carotídeo se
originarían en la cresta neural, no así las del tubo digestivo y el páncreas, cuyo posible
origen sería el endodermo.
Macroscópicamente, los tumores endocrinos aparecen como lesiones bien
delimitadas, parcial o totalmente encapsuladas, que miden desde 1 cm hasta 15 cm.
Microscópicamente pueden adoptar tanto una disposición trabecular, como una
disposición sólida o en rosetas (acinar). El estudio de la pieza operatoria mediante
técnicas de inmunohistoquímica permite identificar uno o más polipéptidos secretados
por el tumor. Sin embargo, es la combinación del síndrome clínico, el análisis
hormonal en sangre por radioinmunoensayo y el estudio postoperatorio por
inmunohistoquímica lo que permite poner el nombre definitivo al tumor endocrino.
Algunos pacientes con síndrome clínico y análisis hormonal característico, no
presentan tumor endocrino alguno sino una hiperplasia difusa de las células de los
islotes. De hecho, la hiperplasia de las células beta o nesidioblastosis es actualmente
la causa del 5 % de las hiperinsulinemias de origen pancreático. Asimismo, se estima
que los síndromes de Zollinger-Ellison y Verner-Morrison se originan en el 10 % de los
casos por hiperplasia.
Una característica anatomopatológica particular de los tumores endocrinos es la
dificultad para establecer su benignidad o malignidad, incluso en el examen de la pieza
quirúrgica.
Solamente las metástasis hepáticas o ganglionares definen a un tumor como maligno.
En cambio, la presencia de figuras mitóticas o pleomorfismo, e incluso la invasión
vascular, perineural o de estructuras vecinas no son criterios histopatológicos válidos.
1. INSULINOMA
Es el tumor endocrino pancreático más frecuente. El 90 % de los insulinomas son
únicos, mientras que el 10 % restante son múltiples o hiperplasias (nesidioblastosis).
El 98 % de ellos se localizan en el páncreas y el 2 % pueden ser hallados en
localizaciones tan diversas como estómago, duodeno, divertículo de Meckel y yeyuno.
La gran mayoría de los insulinotas mide menos de 2 cm.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 45
Epidemiología. La incidencia estimada es de un caso por cada millón de habitantes
por año.
Presentación clínica
Los síntomas y signos más importantes del insulinoma son de origen neurológico.
Consisten en cambios de conducta, alucinaciones, confusión, cefalea, visión borrosa,
parestesias, crisis convulsivas, nístagmo y coma. Todos ellos son secundarios a la
hipoglucemia orgánica resultante de la sobreproducción de insulina por el tumor. La
tríada diagnóstica de la hipoglucemia orgánica fue descripta por Whipple en 1935 y
consiste en: 1) síntomas y signos por hipoglucemia grave; 2) glucemia menor de 0,45
mg/dl; y 3) alivio inmediato del cuadro mediante la administración de azúcar. La
severidad de los trastornos neurológicos hace que los enfermos con insulinoma sean a
menudo tratados por tiempo prolongado en centros psiquiátricos, lo cual retrasa el
diagnóstico y puede ocasionar lesiones cerebrales definitivas.
El insulinoma también puede manifestarse por sintomatología cardiovascular
(palpitaciones, angor, arritmias) o digestiva (vómitos, diarreas).
Laboratorio. Existen diversas pruebas para provocar la hipoglucemia característica
del insulinoma, tales como la administración de tolbutamida, glucagón, calcio o L-
leucina. Sin embargo, la más confiable es la del ayuno de hasta 72 horas, con
determinación periódica de glucemia e insulinemia. Las cifras de glucemia
diagnósticas son menos de 50 mg/dl en el hombre y de 40 mg/dl en la mujer. La
relación de la glucemia con la insulina, medidas simultáneamente, cuyo valor normal
es menor de 0,4, suele ser superior a 1. La prueba de ayuno precipita la tríada de
Whipple a las 12 horas en el 37 % de los casos, en el 74 % a las 24 horas y en el 95 %
a las 72 horas.
La determinación del péptido C durante la hipoglucemia es útil para diferenciar la
hipoglucemia orgánica de la hipoglucemia reactiva o de la provocada con propósito de
simulación.
En la hipoglucemia reactiva o por simulación, la secreción de péptido C se reduce
hasta casi un 50 %, lo cual no ocurre en la hipoglucemia orgánica donde está
aumentado.
En conclusión, el laboratorio permite establecer que existe un insulinoma cuando en la
prueba de ayuno la glucemia desciende por debajo de 0,45 mg/dl, la relación

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 46
insulina/glucemia es mayor de 0,5 y se elevan los niveles de péptido C. Una vez
establecida la presencia del insulinoma, es preciso localizar el tumor.
Métodos por imágenes. La ecografía y la tomografía computada sólo pueden
detectar con seguridad insulinomas mayores de 1,5 cm. Por esta razón, el 30 al 50 %
de los tumores no pueden ser localizados morfológicamente antes de la cirugía
(insulinomas ocultos). Cuando el tamaño del tumor es suficiente como para ser
reconocido, tanto la ecografía como la tomografía computada tienen una eficacia
diagnóstica similar.
Al igual que el resto de los tumores endocrinos, el insulinoma aparece en la ecografía
como una masa hipoecogénica de bordes muy regulares (fig. 39-65). La tomografía
computada debe ser hecha con infusión en bolo de sustancia de contraste (dinámica).
Como consecuencia de la rica vascularización, característica de todos los tumores
endocrinos, eí insulinoma capta intensamente el contraste y se diferencia de los tejidos
vecinos.
Arteriografía, También debido a su hipervascularización, el insulinoma puede ser
identificado por arteriografía. Sin embargo, el método debe realizarse en forma
superselectiva, o sea, inyectando las arterias mesentérica superior, esplénica,
gastroduodenal y pancreática dorsal. Cuando no es realizado de esta manera, la
sensibilidad de la arteriografía es inferior a la de los métodos por imágenes.
Cateterismo transhepático de la vena porta. Las siglas THPS (transhepatic portal
samples) designan a un método que consiste en el cateterismo transhepático de la
vena porta, con el objeto de dosar niveles de insulina en muestras de sangre
recogidas en múltiples sectores del eje venoso esplenomesentérico. Este mapeo
pancreático puede brindar evidencias indirectas sobre la localización del insulinoma
oculto, y pese a ser invasivo, el método ha demostrado ser muy eficaz.
Tratamiento
En el adenoma benigno (la forma más común) está indicada la simple enucleación
quirúrgica sin resección pancreática. Este método es especialmente aplicable en el
insulinoma de la cabeza del páncreas, ya que evita la duodenopancreatectomía
cefálica. Si el tumor se halla en el cuerpo o la cola de páncreas y su enucleación es
difícil por la íntima relación con el conducto de Wirsung o los vasos mayores, es
preciso realizar una pancreatectomía izquierda. Esta técnica también está indicada en
los insulinomas múltiples de cuerpo y cola. Un aspecto esencial durante la cirugía del

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 47
insulinoma es la determinación seriada de la glucemia. Un ascenso brusco de la
glucemia es el signo más objetivo de que la operación ha sido completa. También es
indispensable que el patólogo estudie inmediatamente por congelación la pieza
quirúrgica para confirmar la presencia de tejido tumoral.
En el caso de insulinoma oculto es necesario explorar cuidadosamente por palpación
todo el páncreas. También es de gran utilidad la ecografía intraoperatoria para
confirmar los resultados de la palpación o para descubrir nódulos que han pasado
inadvertidos. Si el insulinoma no fuera detectado por palpación o ecografía, la táctica
dependerá de la existencia de un estudio preoperatorio por cateterismo transhepático
de la vena porta. Cuando se cuenta con ese estudio, se deberá extirpar el sector
marcado como presunto territorio tumoral. En caso contrario existen dos conductas
posibles: 1) resecar a ciegas el cuerpo y la cola del páncreas e investigar de inmediato
en la pieza extirpada la presencia del tumor, y en caso de no hallarlo, extender la
resección a ciegas al istmo y parte de la cabeza del páncreas; o 2) no efectuar
resección alguna y seguir al paciente en el postoperatorio alejado hasta que la
aparición del tumor justifique la reintervención. La elección entre ambas conductas
depende de la gravedad de la sintomatología. La resección a ciegas está indicada en
los pacientes con sintomatología severa, mientras que el control puede ser indicado en
pacientes con sintomatología leve.
En los insulinomas benignos, la cirugía permite la curación definitiva del síndrome
hasta en el 96 % de los casos. En los insulinomas malignos con metástasis hepáticas
la cirugía no está indicada y el tratamiento debe limitarse a la administración de
estreptozotocina.
2. GLUCAGONOMA
Los glucagonomas son casi siempre malignos, de localización exclusivamente
intrapancreática y de un tamaño superior a los 3 cm. Su incidencia es de 0,2 caso por
millón dehabitantes por año.
La sintomatología clínica se debe al exceso de glucagón circulante. El hallazgo más
característico es una dermatitis eccematosa sobre un eritema necrolítico migratorio.
Estas lesiones evolucionan en 7 a 14 días desde máculas eritematosas hasta
ampollas voluminosas con líquido; más tarde con necrosis central y lesiones
eccematosas, para finalizar con un aclaramiento central de las lesiones y
descamación. Aparecen en zonas de fricción como el periné, glúteos y manos, así
como en la cara y las extremidades. También puede existir glositis, estomatitis y

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 48
vulvovaginitis. Todas estas lesiones son similares a las observadas en la carencia de
cinc y aminoácidos, y de hecho, mejoran si se administran estas sustancias.
También es frecuente la intolerancia a la glucosa o la diabetes, la diarrea y una
anemia normocítica y normocrómica.
En todos los casos el nivel sanguíneo de glucagón es superior a los 150 pg/ml, lo cual
permite confirmar el diagnóstico. Debido al tamaño, lo más frecuente es que los
métodos por imágenes identifiquen fácilmente al tumor.
Tratamiento
La resección del sector de páncreas donde asienta el tumor es el tratamiento de
elección. La presencia de metástasis no contraindica la cirugía; por el contrario, de ser
técnicamente posible, se las debe extirpar junto con el tumor primario. La resección
asociada con quimioterapia (dimetiltriazenoimidazol- carboxamida, estreptozotocina y
5-fluoruracilo) ha permitido supervivencias a los 5 años superiores al 50%.

CATEDRÁ DE CIRUGÍA cáncer de páncreas
UNPRG – Facultad De Medicina 49
VII. CONCLUSIONES:
� El conocimiento de la anatomía del páncreas y su relación con órganos vecinos
es crucial para entender la terapia quirúrgica del cáncer pancreático.
� El cáncer de páncreas constituye uno de los procesos oncológicos con peor
pronóstico, de allí la importancia de su conocimiento por parte del medico.
� Entre las medidas en estudio dirigidas a lograr una mayor supervivencia del
paciente están el diagnóstico precoz y el tratamiento más eficaz. Pero hasta que
éstas no se desarrollen favorablemente, es de crucial importancia que el médico
general conozca el proceder diagnóstico-terapéutico de esta entidad, ya que de
su peripecia médica dependerá, en gran medida, el pronóstico del paciente.
� Son varios los factores que se han asociado a un riesgo de cáncer de páncreas,
siendo uno de los más importantes los hereditarios y la pancreatitis hereditaria
con un riesgo de hasta el 40% para desarrollar cáncer de páncreas.
� Las neoplasias pancreáticas pueden clasificarse en tumores del páncreas
exocrino y tumores del páncreas endocrino, y de acuerdo a su naturaleza
histológica, sien uno de los mas importantes por ser el mas frecuente el
adenocarcinoma.
� Ninguno de los actuales marcadores tumorales séricos disponibles es
suficientemente sensible y específico como para ser utilizado de forma
sistemática en el diagnóstico. El CA 19.9 es uno de los marcadores que ha
despertado mayor interés debido a su utilidad sobretodo cuando se usa como
complemento de otras técnicas diagnósticas.
� Es importante la evaluación diagnostica, pronostica y determinar el estadio del
cáncer de páncreas, ya que determinara la actitud terapéutica a seguir.
� El tratamiento del cáncer de páncreas pueden ser terapias quirúrgicas curativas
o cirugías paliativas, además del tratamiento radioterápico y quimioterápico,
según sea la condición del tumor.
VIII. BIBLIOGRAFÍA
� MICHANS: P ATOLOGIA QUIRURGICA. Editorial El Ateneo. Argentina.
� REVISTA MEDICINE, cáncer de páncreas, actualización 2009.
� SCHWARTZ S.S. Principios de la Cirugía. 6a. Edición. México. 1994. Vol. I-lI.
� ROBINS/ Patología estructural y funcional de / 5a. edición