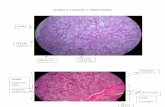
Curso de Actualización en Tumores Neuroendocrinos · hipofisario; b) el resto de las glándulas...
Transcript of Curso de Actualización en Tumores Neuroendocrinos · hipofisario; b) el resto de las glándulas...
Módulo 1. Fisiopatología del sistema neuroendocrino y epidemiología de los tumores neuroendocrinosTema 1. Fisiopatología del sistema neuroendocrino
Aurora Astudillo GonzálezProfesora Titular de Anatomía Patológica. Universidad de Oviedo
1. Definición de sistema neuroendocrino e histogénesis
Todo sistema complejo como el de nuestro organismo precisa una regulación que mantenga el equilibrio u homeostasis, con las necesarias adaptaciones a los cambios internos y del entorno. El disponer de un sistema nervioso y un sistema endocrino integrados es la principal herramienta reguladora. Esta regulación tiene su máxima expresión en el sistema neuroendocrino (SNE), entendiendo como tal algo evolutivamente muy antiguo, que aparece en los animales más primitivos, en forma de un intestino primitivo con regulación a través de neuronas externas a él y que va evolucionando hacia una especialización regional que culmina con la formación de un sistema nervioso, órganos y tejidos endocrinos especializados, y un SNE difuso endodérmico.
El principal eje de la interacción entre el sistema nervioso y el endocrino tiene lugar a través del cerebro, y en él, el hipotálamo, a cuyo nivel se liberan factores que controlan la producción de hormonas hipofisarias, y con ello el control de la reproducción, el crecimiento, el desarrollo, el equilibrio de fluidos y la respuesta al estrés.
El término neuroendocrinología sirve para definir la interacción entre los sistemas nervioso y endocrino en la regulación de la homeostasis, y su estudio se amplía a todo lo relacionado con la producción hormonal y con el mecanismo de transmisión de las señales humorales.
Una gran parte del SNE tiene su origen en la cresta neural: cuando en el desarrollo embrionario unas células más altas del ectodermo dorsal se diferencian en la línea media y van a formar la placa neural, esta se pliega lateralmente para formar el surco neural; de él se aponen las dos superficies apicales más laterales del pliegue o crestas para constituir el tubo neural. Al mismo tiempo que el tubo neural se separa de la lámina ectodérmica suprayacente, las células de la cresta neural comienzan a emigrar desde la parte dorsal del tubo neural hacia los tejidos periféricos. De la cresta neural derivan numerosas estructuras: gran parte de la cabeza deriva de la cresta neural craneal; todo el sistema nervioso periférico procede histogenéticamente de la cresta neural, incluido el sistema nervioso autónomo; todos los paraganglios y la médula suprarrenal y las células C del tiroides. Sin embargo, desde los elegantes experimentos de Nicole Le Douarin con quimeras, se sabe que las células del SNE difuso son una diferenciación de origen endodérmico. Del mismo origen endodérmico son también los islotes de Langerhans del páncreas.
La pituitaria tiene un origen doble: la hipófisis anterior, o adenohipófisis, deriva del endodermo, a partir del epitelio del techo faríngeo, donde se produce una invaginación hacia la base del cráneo denominada bolsa faríngea de Rathke, que aparece ya en la semana 4-5 de gestación. La hipófisis posterior o neurohipófisis se origina del neuroectodermo asociado con el desarrollo del tercer ventrículo.
2. Distribución
El SNE está formado por: a) los núcleos cerebrales que reciben y envían señales para mantener la actividad secretora endocrina. Ese control nervioso de la secreción glandular se establece a través del eje hipotálamo-hipofisario; b) el resto de las glándulas endocrinas: tiroides, paratiroides, suprarrenales, ovarios, testículos y páncreas endocrino; c) el SNE difuso alojado en los órganos con revestimiento mucoso de origen endodérmico.
MÓDULO 1 - TEMA 1
Formación médica continuada. Copyright® GETNE 2018. 1/8
Curso de Actualización enTumores Neuroendocrinos
3.ª edición
3. Funciones
Las células endocrinas y las neuronas son prototipos de células secretoras. Tienen la capacidad de responder a estímulos liberando los productos que albergan. El ámbito de actuación de las sustancias liberadas depende de si se libera directamente a la sangre, en cuyo caso actuarán globalmente como hormonas, o si se vierte en el microentorno, provocando un efecto paracrino en las células de vecindad, que puede ser también autocrino o sobre la propia célula secretora. En el caso de las neuronas, la liberación del neurotransmisor se hace en estructuras muy precisas en las que dos o más células están en estrecho contacto, las sinapsis.
El control hipotalámico de la homeostasis se basa en su capacidad para coordinar las respuestas endocrina, autonómica y de conducta. El hipotálamo recibe señales provenientes del entorno: luz, temperatura, olores; así como señales internas tales como tensión arterial, osmolaridad sanguínea, nivel de glucosa. Además, algunas de sus neuronas son reguladas negativamente por la presencia en sangre de ciertas hormonas (glucocorticoides, estrógenos, testosterona, hormona tiroidea). El hipotálamo integra estos estímulos sensoriales y hormonales, y provoca una respuesta regulada sobre la hipófisis anterior y posterior, la corteza cerebral, las neuronas premotoras, las neuronas del tronco y las neuronas preganglionares del sistema nervioso autónomo. El sistema de control hipotalámico sobre la hipófisis es muy preciso y permite la coordinación de las funciones endocrinas.
La hipófisis está regulada por tres elementos interrelacionados: los estímulos provenientes del hipotálamo, en forma de factores de liberación u hormonas hipofisotrópicas, los efectos de retroalimentación de las hormonas circulantes, y las secreciones autocrinas y paracrinas de la propia hipófisis.
En la hipófisis anterior se distribuyen cinco tipos celulares y se intercalan entre ellos células intersticiales o foliculoestrelladas. Estos cinco tipos celulares son las células corticotropas, que expresan péptidos de proopiomelanocortina, incluida la adeno-cortico-tropohormona; células somatotropas, secretoras de hormona del crecimiento (GH); células tirotropas, que producen la subunidad de la glicoproteína común, y la subunidad de la tirotropina, hormona tiroestimulante específica; células gonadotropas, secretoras de las subunidades y de la hormona folículo-estimulante y la luteohormona; y las células lactotropas, secretoras de prolactina.
Toda la acción neuroendocrina y su coordinación se produce a través de mensajes hormonales, importante sistema regulador que se establece a través de moléculas estructuralmente diversas denominadas hormonas. Por sus características químicas se pueden dividir en: a) derivadas de aminoácidos, como la tiroxina; b) hormonas peptídicas, de las que hay hasta 400 o más; son pequeñas proteínas que van desde un tamaño de solo 3 aminoácidos, como la hormona hipotalámica liberadora de tirotropina, a 192 aminoácidos (la GH); y c) hormonas lipídicas, como los esteroides.
En general, las hormonas se sintetizan en forma de precursores, que precisan de un procesamiento proteolítico postraslacional para su actividad.
4. Glándulas y hormonas neuroendocrinas
4.1. Sistema neuroendocrino gastrointestinal
Forma parte del SNE difuso. Sus células están distribuidas a lo largo del tubo intestinal, en localización intraepitelial, como células aisladas alojadas entre la membrana basal y el epitelio convencional del órgano. Solo son observables al microscopio, y siempre con ayuda de técnicas de marcaje histoquímico o inmunohistoquímico. Si se agruparan, constituirían el órgano neuroendocrino más grande de nuestro organismo.
Las células del SNE difuso han recibido muy diversas denominaciones: Basalgekörnte Zellen de Max Clara, Helle Cellen (célula clara) de Feyrter, célula de Kulchitzki argentafín, células amarillas de Schmidt por fijación con
MÓDULO 1 - TEMA 1
Formación médica continuada. Copyright® GETNE 2018. 2/8
Curso de Actualización enTumores Neuroendocrinos
3.ª edición
bicromato formolado, células argentafines de Masson, células argentocromas de Macklin, células argirófilas de Hamperl, células APUD de Pearse. Su distinción de otros tipos celulares se hace por la presencia de los gránulos de secreción citoplásmicos, que el microscopio electrónico permite ver y que les confiere sus especiales propiedades tintoriales. La primera tinción distintiva usada fueron sales de cromo, demostrando la afinidad del tumor por ellas o cromafinidad (Masson, 1914). Posteriormente se detectó su afinidad por las sales de plata o argentafinidad (capacidad de reducir sales de plata y acumular la parte metálica). Pero algunas de estas células son argirófilas o argento-reductoras, que no argentafines. Esto significa que reducen la plata y se ven al microscopio mediante la ayuda adicional de un agente reductor (Dawson, 1948). Hoy en día, con las técnicas de inmunohistoquímica conocemos con más precisión el contenido de las vesículas citoplásmicas de neurosecreción que propiciaban la afinidad por estos colorantes y que caracterizan a estas células y a los tumores neuroendocrinos que se desarrollan a partir de sus células progenitoras.
El tipo de secreción de estas células es muy variado. Podemos hacer un esquema de los principales tipos celulares distribuidos a lo largo de todo el tracto gastrointestinal (TGI), sus productos de secreción y sus principales dianas (tabla 1).
Tabla 1. Tipos celulares neuroendocrinos del tracto gastroenteropancreático
Hormona Célula Localización DianaColecistoquinina I Duodeno Páncreas, vesícula biliar
Enteroglucagón Celulas páncreas Páncreas, ID
Gastrina G Estómago, duodeno Células parietales gástricas
Ghrelina Estómago Hipófisis anterior
GIP K Intestino proximal Estómago, ID
Histamina ECL Estómago Secreción ácida gástrica
Motilina Mo TGI Estómago, intestino
Péptido PYY P Íleon distal y colon Páncreas, estómago, intestinoPolipéptido pancreático PP Islotes de
Langerhans Páncreas exocrino
Serotonina EC TGI TGI, otros
Secretina S Duodeno Hígado, páncreas, duodeno Brunner
Somatostatina D TGI Hipófisis anterior, estómago, TGI, páncreas, v. biliar, m. liso
ECL: enterocromafín-like; TGI: tracto gastrointestinal.
A pesar del precoz descubrimiento del SNE del TGI (la primera descripción de células endocrinas productoras de péptidos en la mucosa gástrica fue de Heidenheim en 1870, que describió células cromafines en la mucosa gástrica de perros), la mejor comprensión de sus características y funciones estuvo limitada por la carencia de herramientas para la investigación. Pero todo cambió en las décadas de los años sesenta y setenta, cuando se descubrieron métodos para la extracción y purificación de péptidos presentes en muy baja concentración; también con la inmunocitoquímica, que permitió la localización e identificación de los distintos tipos de neuropéptidos y el radioinmunoensayo que permitió medirlos. En esa misma época, la cromatografía permitía su caracterización química.
Hoy se sabe que estas células forman parte del sistema funcional y que actúan como detectores locales mucosos junto con los sistemas neuronal e inmune, provocando las respuestas reguladas de motilidad, secreción, defensa y
MÓDULO 1 - TEMA 1
Formación médica continuada. Copyright® GETNE 2018. 3/8
Curso de Actualización enTumores Neuroendocrinos
3.ª edición
perfusión. Sus productos forman parte de la vía humoral de información a otros órganos y al sistema nervioso central. A este respecto, uno de los últimos neuropéptidos descubiertos, la ghrelina, producida por células del estómago, el hipotálamo y la hipófisis, ilustra la importancia de la interdependencia del estómago y el hipotálamo. Descubrir su existencia ha sido crucial para comprender la regulación del balance energético, el crecimiento y la función gastrointestinal coordinada.
Las células del SNE del TGI se distribuyen a todo lo largo del tubo digestivo, pero como puede verse en la tabla 1, cada territorio tiene unos tipos celulares predominantes. Así, de las células neuroendocrinas gástricas, que son un 1,2 % de todo el volumen del epitelio gástrico, un 30-35 % son de tipo enterocromafín-like, se localizan en el fundus y son reguladores endocrinos críticos de la función de esta mucosa. Su interacción con otras células del mismo sistema es un buen ejemplo de la interacción funcional: son células secretoras de histamina, principal estimulador de las células parietales secretoras de clorhídrico, y están reguladas por el estímulo del sistema nervioso vegetativo, el nervio vago, y por las células G de la mucosa antral secretoras de gastrina y las células I secretoras de colecistocinina. También son reguladas negativamente por el estímulo hormonal regional de las células «D», secretoras de somatostatina.
4.2. Páncreas
El páncreas endocrino supone una pequeña parte de todo el órgano, aproximadamente un 2 % de su masa. Está constituido por los islotes de Langerhans, agregados celulares bien circunscritos, muy bien vascularizados, distribuidos difusamente por el órgano, de tamaño variable, entre 75 y 225 micras, y un número entre 600.000 y 2.000.000.
Sus capilares tienen un endotelio fenestrado y doble membrana basal.
La mayoría de sus células (70 %) son de tipo , de localización más hacia la zona central del islote, y sintetizan insulina y amilina. El 20 % son de tipo , de localización más bien periférica en el islote, y producen glucagón. Hay también un 10 % de células D productoras de somatostatina. Hay también una mínima producción de otras hormonas (polipéptido pancreático, gastrina).
Insulina y glucagón son hormonas clave en el metabolismo.
La unión de la insulina a sus receptores celulares da lugar a cambios metabólicos y afecta a la expresión de muchos genes. El receptor insulínico está formado por dos subunidades que fijan la hormona y otras dos que tienen actividad enzimática, poniendo en marcha una cascada metabólica de control de muchas enzimas clave de rutas metabólicas. Una de las respuestas más rápidas es la entrada incrementada de glucosa que se logra mediante la translocación de transportadores de glucosa desde un almacén intracelular a la membrana celular. La insulina es capaz también de regular la cantidad de sus propios receptores estimulando su endocitosis y degradación. La insulina estimula la captación de glucosa, su almacenamiento en glucógeno y la glucólisis; estimula la síntesis de glicerol, favorece la captación de amionácidos de la sangre, inhibe la actividad lipasa de los adipocitos e inhibe el catabolismo proteico.
El glucagón, como antagonista de la insulina, activa la glucogenólisis, la gluconeogénesis, la proteólisis y la movilización de grasas.
Aunque el control de la insulina está regulado por los niveles de glucosa en sangre, también arginina y leucina son potentes estimuladores. Aproximadamente dos tercios de la respuesta insulínica a la ingesta oral de glucosa se establece a través de la potenciación de hormonas intestinales denominadas incretinas, en las que se incluye el polipéptido insulinotrópico glucosa-dependiente y el péptido glucagon-like 1.
MÓDULO 1 - TEMA 1
Formación médica continuada. Copyright® GETNE 2018. 4/8
Curso de Actualización enTumores Neuroendocrinos
3.ª edición
La glucemia se mantiene normalmente entre 4-6 mmol/l (80-120 mg/100 ml), debido a las interacciones de varias hormonas: insulina, glucagón, GH, adrenalina y cortisol.
4.3. Sistema neuroendocrino pulmonar
Feyrter y Fröhlich identificaron por primera vez las células neuroendocrinas pulmonares como células claras intraepiteliales, aisladas y dispersas, distinguibles de las vecinas del epitelio bronquial. Pertenecen al SNE difuso de origen endodérmico y su función no es muy bien conocida. Su diferenciación embriológica es precoz y probablemente todas deriven de la parte más proximal de la mucosa respiratoria. De hecho, solo están presentes entre el epitelio bronquial, y están ausentes en alveolos y sacos alveolares. Se han descrito unas células precursoras, PNEC o preneuroendocrinas, que expresan inicialmente enolasa neuronal específica y serotonina, y que se pueden ver a partir de la octava semana de gestación. Se piensa que durante las fases precoces de la organogénesis podrían actuar como moduladores locales de crecimiento y diferenciación, pero durante la vida adulta es más difícil dilucidar su papel. Debido a que se pueden observar en los adultos pequeños grupos de 3-5 células neuroendocrinas bronquiales, secretoras de serotonina y bombesina, y que algunos pocos grupos están inervados, se especula con que puedan funcionar como quimiorreceptores.
4.4. Tiroides
Esta glándula se relaciona filogenéticamente y en la embriogénesis con ciertos aspectos funcionales del TGI. En animales inferiores, hay células con capacidad para captar yodo, pero solo es a partir de los mamíferos cuando se observan estructuras glandulares hormonales específicas para este fin. Si bien también la glándula salivar y las glándulas gástricas son, con el tiroides, capaces de concentrar yodo en las secreciones, en las primeras el transporte de yodo no responde a la hormona estimulante del tiroides (TSH).
El tiroides deriva embriológicamente de un engrosamiento del epitelio del suelo faríngeo (primordio) que luego forma un divertículo adyacente al primordio miocárdico. Durante su desplazamiento caudal, adquiere una forma bilobulada. Se pone en contacto y fusiona con el aspecto ventral de la cuarta bolsa faríngea cuando alcanza su posición final. Normalmente el conducto tirogloso sufre fragmentación y disolución al segundo mes.
Las células de la porción caudal del ducto se diferencian en tejido tiroideo, formando el lóbulo piramidal. En ese punto, los lóbulos laterales contactan con el cuerpo ultimobranquial, originando la incorporación de las células C. El tiroides es activo, de modo que a las 13-14 semanas de gestación es ya capaz de formar coloide y al día 29 de la gestación ya produce tiroglobulina.
El tiroides adulto posee una fina cápsula, que emite finos tabiques hacia el interior. Está muy vascularizado y posee capilares fenestrados. El denso parénquima está formado por vesículas o folículos tiroideos; son miles y constituyen la unidad funcional del tiroides. Los folículos tiroideos están tapizados por un epitelio cúbico, que puede ser aplanado cuando el contenido de coloide que se aloja en la luz está sometido a tensión. Sus células constituyentes son las células foliculares, que fabrican y almacenan la hormona en el folículo y en función de la demanda absorben el coloide y generan pequeñas vacuolas esféricas vacías. Poseen receptores para la TSH en su zona basal y segregan las hormonas hacia la luz coloide en su zona apical. En el folículo también hay células «C» o parafoliculares dentro de la lámina basal del folículo.
El tejido tiroideo produce tres hormonas que tienen un amplio rango de acción en la homeostasis fisiológica. Las células foliculares producen tiroxina (T4) y triyodotironina (T3), mientras que las células C producen calcitonina. El mecanismo de contrarregulación de la adenohipófisis y del hipotálamo ayuda a regular la función tiroidea.
Para la síntesis de T4 se requiere yodo, cuyo balance se mantiene a partir de diversas fuentes. El yodo es concentrado a partir del obtenido de la dieta y del reciclado por el cuerpo. En la glándula es oxidado a su forma
MÓDULO 1 - TEMA 1
Formación médica continuada. Copyright® GETNE 2018. 5/8
Curso de Actualización enTumores Neuroendocrinos
3.ª edición
orgánica por la tiroperoxidasa (TPO) localizada en la membrana apical del folículo. El peróxido de hidrógeno y la TPO yodan los residuos tiroxil de la tiroglobulina. Las yodotiroxinas, hormonalmente inactivas, se incorporan en la tiroglobulina como yodotironinas, las formas activas de T3 y T4. El proceso de oxidación ocurre dentro de la gran molécula tiroglobulina. Para que se sinteticen eficientemente las hormonas, se requiere la presencia de tiroglobulina.
4.5. Médula suprarrenal
Las células que forman la médula adrenal se conocen como células cromafines, ya que presentan una fuerte reacción tintorial ante el ácido crómico o las sales de cromo (tales como el dicromato potásico).
Las células cromafines se organizan en agrupaciones de aspecto globular o ligeramente alargado, separadas por tabiques de tejido conectivo altamente vascularizado. En estos tabiques se pueden encontrar neuronas que deben ser consideradas neuronas preganglionares (simpáticas), ya que las propias células cromafines son neuronas posganglionares modificadas.
Las células cromafines secretan catecolaminas (adrenalina y noradrenalina). Las catecolaminas son los neurotransmisores y hormonas no solo de la médula suprarrenal, sino también del sistema neuronal simpático y del sistema catecolaminérgico cerebral. Fue en 1895 cuando Oliver y Schafer publicaron los efectos cardiovasculares de los extractos de las suprarrenales. Dos años más tarde, Abel y Crawford identificaron a la adrenalina como la sustancia endógena activa. Poco después, Takamine aisló la adrenalina en forma cristalina y comunicó su estructura química. Así, fue la primera catecolamina y la primera hormona identificada.
La noradrenalina fue descubierta a mediados del siglo XX (1946) por Ulf von Euler como neurotransmisor de los nervios simpáticos y como precursor de la adrenalina.
Fue el fisiólogo Walter Cannon quien estudió en humanos y animales la importancia de la secreción hormonal de la médula suprarrenal ante varios tipos de estímulos y acuñó el término de homeostasis. En relación con su equilibrio funcional, Goldstein introdujo una nueva definición de «estrés». Según su teoría, el cuerpo posee numerosos comparadores homeostáticos que regulan la actividad de un mismo efector. Por ejemplo, osmostatos y volustatos comparten el efecto vasopresina. Él define el estrés como la condición en que las expectativas, genéticamente programadas o aprendidas, o deducidas por las circunstancias, no coinciden con la percepción anticipada del entorno interno o externo, y esta discrepancia entre lo observado o sentido y lo esperado o programado da lugar a respuestas compensadoras que siguen unos patrones. Cuando el estrés activa el eje hipófiso-adrenocortical y adrenomedular, se produce el distrés, con signos observables. Este puede empeorar algunos procesos fisiopatológicos. Para su mejor comprensión, en la investigación del estrés se introdujo el término de «alostasis», refiriéndose al proceso de adaptación del cuerpo a la exposición a varios estresores. Cuando los mediadores de la alostasis, como la adrenalina o el cortisol, son liberados en respuesta al estrés o a los estilos de vida, promueven adaptación. Pero si el estrés se prolonga o su activación no remite al cesar el estrés, hay cambios acumulativos que dan lugar a la «sobrecarga alostática».
Es importante conocer correctamente la función del sistema catecolaminérgico en condiciones basales y de estrés. Hay tres sistemas catecolaminérgicos regulados de manera diferencial: el simpato-adrenomedular, el simpatoneural y el DOPA-dopamina autocrino-paracrino.
El proceso de liberación de las catecolaminas es similar en la médula suprarrenal y en las terminales nerviosas simpáticas. La acetilcolina liberada de las terminales nerviosas preganglionares se une a receptores nicotínicos colinérgicos y da lugar a la despolarización de la membrana, con aumento de la permeabilidad para el sodio. Esto inicia una serie de eventos que dan lugar a un aumento en el influjo de calcio citosólico. Con ello las vesículas de neurosecreción se fusionan con la membrana y, vía exocitosis, liberan su contenido de neurotransmisor. Las células de la medular suprarrenal segregan su contenido directamente en el torrente sanguíneo.
MÓDULO 1 - TEMA 1
Formación médica continuada. Copyright® GETNE 2018. 6/8
Curso de Actualización enTumores Neuroendocrinos
3.ª edición
4.6. Paraganglios
Son estructuras relacionadas con nervios y vasos arteriales, en general de pequeño tamaño, formadas por agrupaciones celulares ricamente vascularizadas y encapsuladas de células cromafines que contienen catecolaminas. Al microscopio se observa que están formados por nidos celulares densamente agregados (zellballen) en los que las células centrales, grandes, se denominan células principales, que están rodeadas por células periféricas sustentaculares, menos visibles. El marcaje inmunohistoquímico las delinea muy bien, al ser solo las células principales positivas para cromogranina y sinaptofisina, mientras que solo las sustentaculares son positivas para S-100.
Se distinguen según su distribución anatómica, inervación y microscopía en varias familias: a) paraganglios branquioméricos, relacionados con arcos y hendiduras branquiales; b) paraganglios intravagales; c) paraganglios aorto-simpáticos; d) paraganglios autónomo-viscerales. De las dos primeras derivan todos los paraganglios cervicocefálicos: yugulotimpánicos, orbitarios, intercarotídeos, subclavios y laríngeos.
Son glándulas neuroendocrinas especializadas, asociadas al sistema nervioso autónomo. Los de mayor tamaño actúan como quimiorreceptores.
4.7. Sistema neuroendocrino difuso de otros órganos
Además del SNE difuso pulmonar y del TGI, otras mucosas de origen endodérmico e incluso de otras hojas blastodérmicas forman parte de este sistema. Entre las de origen endodérmico, se encuentra el SNE difuso de la mucosa nasal: durante muchos años, su epitelio se consideró simplemente como una barrera física, hasta que se descubrió su capacidad para producir citocinas, chemocinas y neurotrofinas, debido a la presencia de células neuorendocrinas intraepiteliales dispersas entre el epitelio respiratorio, con superficies apicales que alcanzan la luz.
También se han descrito células neuroendocrinas difusas en el riñón, tanto entre las células del epitelio transicional que reviste la pelvis, como en el propio parénquima renal, a nivel tubular. El epitelio transicional que tapiza la vejiga también posee células neuroendocrinas dispersas. Su papel funcional es poco conocido.
En el aparato genital femenino se han descrito células neuroendocrinas en el cérvix, posible origen de los tumores neuroendocrinos descritos en esta región, que suelen ser carcinomas neuroendocrinos que expresan citoqueratina 20.
En la piel, se conoce la existencia de células neuroendocrinas dispersas intraepiteliales, conocidas como células de Merkel, difíciles de ver con tinciones habituales, pero que se ponen en evidencia con marcaje inmunohistoquímico, ya que poseen gránulos de neurosecreción. También tienen en su citoesqueleto cotoqueratinas, siendo característica de estas células y sus tumores la expresión de citoqueratina 20 en forma de «dot» paranuclear. Su función se relaciona con la transmisión de estímulos mecánicos a las neuronas sensoriales.
En el timo también se ha descrito la presencia de células neuroendocrinas dispersas, tanto en la zona cortical como en la medular, con distintos tipos de neurosecreción, lo que puede indicar la diversidad de sus funciones biológicas. En este órgano, la propia red de células reticuloepiteliales del microentorno estromal tímico también contribuye a la regulación neuroendocrina, al producir y secretar las hormonas tímicas alfa 1 timosina y timopoyetina, además de numerosas citocinas. Esta función hormonal, indicativa del diálogo entre el sistema inmune y el neuroendocrino, es una más de las funciones que ejerce el SNE difuso en los órganos en los que está presente.
MÓDULO 1 - TEMA 1
Formación médica continuada. Copyright® GETNE 2018. 7/8
Curso de Actualización enTumores Neuroendocrinos
3.ª edición
5. Bibliografía recomendada
1. Angeletti RH, Hickey WF. A neuroendocrine marker in tissues of the immune system. Science 1985;230:89-90.2. Carretero-González J, Blanco-Pérez P, Vázquez-Osirio MT, Benito-González F, Sañudo-Tejedo JR.
Paragangliomas cervicocefálicos. Origen embriológico y características anatómicas: distribución topográfica ypatrón de vascularización. Acta Otorrinolaringol Esp 2009;Supl 60:9-17.
3. D'Andrea V, Malinovsky L, Berni A, Biancari F, Biassoni L, Di Matteo FM, et al. The immunolocalization of PGP9.5 in normal human kidney and renal cell carcinoma. G Chir 1997;18:521-4.
4. Johnson EW, Eller PM, Jafek BW. Protein gene product 9.5-like and calbindin-like immunoreactivity in thenasal respiratory mucosa of perinatal humans. Anat Rec 1997;247:38-45.
5. Jornot L, Lacroix JS, Rochat T. Neuroendocrine cells of nasal mucosa are a cellular source of brain-derivedneurotrophic factor. Eur Respir J 2008;32:769-74.
6. Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasingacylated peptide from stomach. Nature 1999;402:656-60.
7. Kventianski R, Sabban EL, Palkovitis M. Catecholaminergic systems in stress: structural and molecular geneticapproaches. Physiol Rew 2009;89:535-606.
8. Linnoila RI. Functional facets of the pulmonary neuroendocrine system. Lab Invest 2006;86:425-44.9. Montuenga LM, Guembe L, Burrell MA, Bodegas ME, Calvo A, Sola JJ, et al. The diffuse endocrine system:
from embryogenesis to carcinogenesis. Prog Histochem Cytochem 2003;38:155-272.10. Rindi G, Leiter AB, Koplin AS, Bordi C, Solcia E. The «normal» endocrine cell of the gut. Changing concepts
and new evidences. Ann NY Acad Sci 2004;1014:1-12.11. Sie kiewicz A, Olszewska M, Olszewska E, Garbowicz M, Trojan S, Chyczewski L, et al. Neuroendocrine cells
in the nasal mucosa - preliminary report. Folia Histochem Cytobiol 2007;45:123-7.12. Silva AB, Aw D, Palmer DB. Evolutionary conservation of neuropeptide expression in the thymus of different
species. Immunology 2006;118:131-40.13. Vittoria A, Paino G, La Mura E, Budetta G, Cecio A. Chromogranin- and somatostatin-containing
neuroendocrine cells in the porcine uterus. An immunocytochemical study. Anat Histol Embryol1989;18:136-42.
14. Kronenberg HM. Williams Textbook of Endocrinology. 11th edition. Amsterdam: Saunders; 2007.
MÓDULO 1 - TEMA 1
Formación médica continuada. Copyright® GETNE 2018. 8/8
Curso de Actualización enTumores Neuroendocrinos
3.ª edición