Manual de Prácticas de Química Inorgánica Web viewRealiza una tabla que...
Transcript of Manual de Prácticas de Química Inorgánica Web viewRealiza una tabla que...

tecnológico de estudios superiores de coacalco
Manual de Prácticas de Química Inorgánica
INGENIERÍA QUÍMICA
Q.B.P Elizabeth Mercado Herrera, I.B.Q. Ma. del Carmen Domínguez Reyes
28/08/2012
Revisó: I.Q. Beatriz Contreras Navarro.

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICAINDICE:
Práctica No. 1: “Conocimiento de las reglas de laboratorio”…………………………………….….3 Práctica No. 2: “Identificación y manejo del material de laboratorio”…………………………....9Práctica No. 3: “Base experimental de la Teoría Cuántica”……………………………………..15Práctica No. 4: “Operaciones básicas en el laboratorio: filtración, decantación, cristalización”…………………………………………………………………………………………..19Práctica No. 5: “Periodicidad química”……………………………………………………………..23Práctica No. 6: “Nomenclatura de óxidos básicos e hidróxidos”………………………………..28Práctica No. 7: “Nomenclatura de anhídridos, ácidos y bases”…………………………………37Práctica No. 8: “Enlaces químicos”………………………………………………………………….44Práctica No. 9: “Estequiometría I: Eficiencia de una reacción y fórmula mínima”…………….50Práctica No. 10: “Estequiometría II: Peso equivalente”…………………………………………..55Anexo I: Diversos materiales de laboratorio………………………………………………………..60Anexo II: Diversos dispositivos de laboratorio……………………………………………………..63Anexo III: Tabla de aniones y cationes………………………………………………………….….64Referencias consultadas……………………………………………………………………………….65
2

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
PRACTICA No. 1CONOCIMIENTO GENERAL DE LAS REGLAS DEL LABORATORIO
ALUMNO (A):_____________________________________________________ GRUPO: ___________PROFESOR (A):___________________________________________________ FECHA: ____________
COMPETENCIAS: Al término de la práctica el alumno:
a) Identifica las medidas de seguridad e higiene necesarias para el manejo correcto de las substancias y materiales de laboratorio.
b) Conoce las medidas de seguridad requeridas para el trabajo en equipo y ayuda a sus compañeros en caso necesario.
CONSIDERACIONES TEORICAS:
Investigue en la bibliografía correspondiente:
¿Cuáles son los tipos de laboratorio, sus usos principales y las medidas de seguridad más comunes?
¿Qué equipo de protección personal es el recomendado para un laboratorio escolar de química básica?
¿Qué equipo de seguridad es adecuado para un laboratorio pesado de ingeniería química? Observar el video: Instrumental y equipos de protección.
REGLAS DE HIGIENE Y SEGURIDAD EN EL LABORATORIO DE QUIMICA
1. Portar indiscutiblemente una bata blanca en el laboratorio
2. No colocar sobre las mesas de trabajo útiles, suéteres, ni artículos personales ajenos a la práctica.
3. NO FUMAR
4. No ingerir alimentos ni bebidas dentro del laboratorio. No utilizar materiales propios del laboratorio como recipientes para comer o beber. (el material puede estar contaminado con sustancias toxicas o corrosivas que pueden causarte un accidente o incluso la muerte).
5. Lavarse las manos frecuentemente.
6. No usar lentes de contacto durante el desarrollo de algún experimento que intervenga sustancias volátiles o peligrosas.
7. Utilizar el equipo de protección personal que indica el profesor para cada sesión.
8. Mantener el área de trabajo perfectamente limpia.
9. Investigar la peligrosidad de cada uno de los reactivos a utilizar en cada práctica para minimizar los riesgos (Hojas de seguridad).
3

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA10. En caso de accidente avisar de inmediato al profesor, por muy leve que parezca.
11. Realiza el experimento según el procedimiento señalado. No hagas modificaciones a las prácticas sin previas consultas al profesor.
12. Leer las etiquetas antes de utilizar los reactivos; nunca regreses el reactivo al frasco. Si tomaste una cantidad mayor de reactivo, deja el exceso para otro compañero o trasvásalo a un frasco y etiquétalo.
13. Calentar lentamente el material de vidrio. Cuando se caliente una sustancia en cualquier tipo de material, cuida que el material no se proyecte a ti o a tu compañero.
14. Nunca pruebes, olfatees ni tomes un reactivo. Cuando se necesite oler un reactivo, no lo hagas directamente al recipiente; abanica con las manos los vapores y entonces con suma precaución oler.
15. Nunca verter agua sobre ácidos concentrados. Siempre agrega lentamente el acido sobre el agua mientras se mezcla
16. Si se desprenden gases durante el experimento, realízalo bajo le campana de extracción.
17. Los reactivos que ya no sirven, viértelos en los recipientes que indique el profesor.
18. No tirar sustancias sólidas en las tarjas.
19. No manipular las llaves de gases (cuando no se requiere)
20. Cuando se termina un experimento, lavar todo el material, secarlo perfectamente bien y guardarlo.
COMUNICACIÓN DE RIESGOS
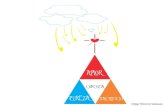
La comunicación escrita o por símbolos es parte inherente de nuestra naturaleza humana, para esto se ha diseñado una forma muy visual en la cual nosotros a través de símbolos, números y colores conoceremos los riesgos potenciales que tienen cada una de las sustancias. A continuación conoceremos las etiquetas de seguridad o rombos de seguridad, en el cual tenemos colores, números y símbolos que deberemos aprender para identificar una sustancia.
COLORES
Existen cuatro colores: azul, rojo, amarillo y blanco. El AZUL se refiere a los riesgos o peligros a la SALUD. El ROJO se refiere a los riesgos o peligros INFLAMABLES. El AMARILLO se refiere a los riesgos o peligros de REACTIVIDAD. El BLANCO, se refiere a los riesgos y peligros en CASOS ESPECIALES
NUMEROS
El CERO indica MINIMO peligro. El UNO indica peligro LIGERO El DOS indica peligro MODERADO
4

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA El TRES indica peligro SERIO El CUATRO indica peligro SEVERO
SIMBOLOS
Únicamente se utilizara el área blanca y son casos especiales:
SOBRE LOS SERVICIOS QUE PRESTAN LOS TALLERES Y LABORATORIOS
I. Los servicios de los Talleres y Laboratorios se proporcionarán por conducto del responsable del área correspondiente y sus auxiliares.
II. Los servicios que proporcionan los Talleres y Laboratorios son:a. Préstamo del equipo e instalaciones para el desarrollo de las prácticas establecidas en el
periodo escolar, para atender las horas prácticas de las asignaturas que se están impartiendo.b. Asesoría para la operación del equipo.c. Préstamo del equipo e instalaciones para exposiciones y eventos académicos dentro del
TESCo siempre que esto no afecte las asignaturas.
III. El préstamo del equipo y herramienta para exposiciones y eventos académicos, deberá solicitarse mediante el formato: Vale de Equipo de Talleres y Laboratorios FO-TESCo-68, debidamente llenado y la credencial institucional de quien hace la solicitud.
IV. El acceso de usuarios a los Talleres y Laboratorios quedará restringido al horario de servicio establecido.
V. En período escolar el horario de servicio de los Talleres y Laboratorios será establecido conforme a las necesidades de las asignaturas y talleres de apoyo académico determinados al inicio del semestre.
5

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICAVI. Las acciones de mantenimiento preventivo y correctivo del equipo se realizarán preferentemente en
periodo inter-semestral y de ser requeridas durante el periodo escolar, se restringirá el acceso, previa notificación a los usuarios del equipo intervenido.
SOBRE LOS DERECHOS Y OBLIGACIONES DE LOS USUARIOS
I. Son derechos de los usuarios:a. Tener acceso al uso del equipo e instalaciones de los Talleres y Laboratorios del TESCo durante
el horario de servicio.b. Recibir asesoría para el uso del equipo y las instalaciones, así como la información acerca de
los servicios que proporcionan los Talleres y Laboratorios del TESCo, por parte del responsable del Taller y/o Laboratorio.
c. La asignación del equipo y herramienta requeridos para el desarrollo de prácticas.d. El préstamo del equipo y herramienta requeridos para la realización de exposiciones en eventos
académicos, previa planeación elaborada en el Formato de Programación de Prácticas Fo-TESCo-67 autorizada por la Jefatura de División correspondiente.
II. Son obligaciones de los usuarios:1. Observar, sin excepción, los presentes lineamientos.2. Presentar la credencial vigente del TESCo para la asignación del equipo y uso de las instalaciones.3. Utilizar bata en el área de trabajo del Taller o Laboratorio.4. Respetar la tolerancia de entrada de 10 minutos después de la hora asignada para la clase.5. Hacer uso adecuado de las instalaciones, equipo y material asignados para el desarrollo de las
prácticas o eventos académicos especiales.6. Observar, sin excepción, las medidas de higiene y seguridad publicadas en cada Taller o
Laboratorio, así como el uso obligatorio del equipo de protección que corresponda.7. Abstenerse de entrar con mochilas, portafolios o bolsas al área de trabajo, debiendo depositar
dichas pertenencias no necesarias para el desarrollo de las prácticas en el espacio destinado para su guarda y custodia.
8. Abstenerse de introducir y conectar todo tipo de equipo eléctrico o electrónico ajeno a las instalaciones del Taller o Laboratorio sin la autorización del responsable.
9. Entregar al responsable del Taller o Laboratorio, el equipo utilizado en las mismas condiciones en que se recibió, antes de salir de las instalaciones.
10. Abstenerse de introducir y/o consumir alimentos, así como de ingerir bebidas en las instalaciones del Taller o Laboratorio.
11. Abstenerse de fumar en las instalaciones del Taller o Laboratorio.12. Abstenerse de arrojar basura fuera de los cestos destinados para ello.13. Tratar con orden, cortesía y respeto al personal académico, de servicio y usuarios en general.14. Reportar al encargado cualquier falla o deterioro en el equipo asignado.15. Reparar o reponer el equipo dañado o extraviado, en caso de comprobarse la responsabilidad o
negligencia del usuario.16. Y las demás obligaciones que para tal efecto se establezcan.
6

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
DESARROLLO:
De la información leída anteriormente y en conjunto con la información investigada realiza:
a) Un mapa mental titulado “Laboratorio y sus reglas de seguridad”. Puedes apoyarte de imágenes o fotos.
b) Contesta las siguientes cuestiones:
1. De la información que se le proporciono en el laboratorio elabore un listado de lo que le parece a usted más importante para trabajar en el laboratorio.
2. Mencione los elementos necesarios para un botiquín en el laboratorio.3. Mencione los cuidados que debe de tener al mezclar un ácido con agua.
7

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
CONCLUSIONES:
REFERENCIAS EMPLEADAS:
8

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
PRÁCTICA No. 2IDENTIFICACIÓN Y MANEJO DEL MATERIAL DE LABORATORIO
COMPETENCIAS: Al término de la práctica el alumno:
Identifica y maneja el material básico de laboratorio para emplearlo durante el desarrollo de las prácticas de manera adecuada y responsable.
CONSIDERACIONES TEORICAS:
Nota: Investigar previamente la clasificación de los materiales de laboratorio.
Los equipos y materiales que se usan en el laboratorio de química constituyen los elementos con los cuales se hacen los experimentos y las investigaciones. Para trabajar con eficiencia en el laboratorio es necesario conocer los nombres de los diferentes utensilios, hacer un diagrama y conocer su uso.
Todo lo anterior es con la finalidad de lograr los diversos objetivos de un laboratorio de Química Inorgánica, de los cuales podemos mencionar algunos muy importantes como los siguientes:
a) Darle oportunidad al alumno de comprobar personalmente las propiedades físicas y químicas de los diferentes grupos de sustancias tratadas en teoría, al mismo tiempo se fomenta el interés del alumno por la Química.
b) Incrementar su habilidad manual, criterio y confianza para efectuar reacciones.c) Desarrollar su capacidad para plantear un experimento original.d) Desarrollar su capacidad para registrar sus observaciones en forma metódica, exacta, completa e
inteligible.e) Familiarizar al alumno en las operaciones o reacciones más comunes en Química, así como sus
limitaciones y riesgos.
Para que estos fines se logren se necesita la ILIMITADA COOPERACIÓN Y COMPROMISO DEL ALUMNO, el cual deberá considerar lo siguiente:
I Estudiar cuidadosa y ampliamente la teoría de la práctica asignada antes de empezar su ejecución, de esta manera estará preparado, comprendiendo la idea básica sobre el desarrollo de la misma.
II Plantear el desarrollo de la práctica, buscando el porqué de cada uno de los pasos de ésta. Las siguientes preguntas se pueden plantear en casi todos los experimentos:
(1) ¿Las cantidades de los reactivos corresponden a las cantidades teóricas? ¿Que sucederá si se cambian las cantidades?
(2) ¿Por qué se han de emplear las condiciones experimentales indicadas? ¿Qué pasa si se eleva o baja la temperatura de la reacción?
(3) ¿Como se puede averiguar cuando se ha completado una reacción?(4) ¿Cuál es la finalidad de cada paso del experimento?
III Durante la ejecución del experimento se debe observar y anotar lo siguiente:
1. Los cambios térmicos.2. Formación de colores.
9

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA3. Formación de precipitados.4. Disoluciones.5. Espuma.6. Separación de capas líquidas.7. Desprendimiento de gases.8. Y en general todo lo que ocurra durante la práctica.
IV. Estudiar cada uno de los movimientos realizados para determinar las condiciones favorables para incrementar la eficiencia del trabajo y disminuir el desperdicio de energía y el tiempo empleado en armar aparatos defectuosos, etc.
V. Cuándo se suspenda un experimento, asegúrese de lo siguiente:
a) De que no habrá reacciones secundarias o descomposición antes de que se reanude la práctica.b) De que se ha anotado en todos los recipientes, tubos, matraces, etc. La naturaleza del contenido y
que se ha registrado en la libreta de laboratorio el estado del experimento en el momento de su interrupción.
VI. Actuar siempre con PRECAUCIÓN y evitar dejar al azar los resultados de un experimento o material sin identificar. ¡Puede ser un día de mala suerte!
PROCEDIMIENTO 1:
MATERIALES:
No. MATERIAL REACTIVOS1 DISTINTOS UTENCILIOS DEL LABORATORIO NINGUNO2 MECHERO DE BUNSEN3 TUBO DE VIDRIO4 MARIPOSA O ADAPTADOR
PROCEDIMIENTO:
1. Observar y escuchar con atención cada una de las explicaciones que el profesor dará sobre los diversos materiales utilizados en el laboratorio.
2. Realiza una tabla que contenga los siguientes datos: (si requieres más espacio puedes hacerlo al reverso de esta hoja o anexar en hojas blancas).
Nombre del material Dibujo Clasificación Uso o descripción
10

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
PROCEDIMIENTO 2:
MATERIALES:
No. MATERIAL REACTIVOS1 Balanza granataria NINGUNO2 Balanza analítica3 Diversos objetos.
1. Pesar en la balanza granataria y luego en la balanza analítica algunos objetos como anillos, aretes, relojes, etc. (previa explicación del profesor para el manejo de las balanzas).
2. Anotar los pesos obtenidos del punto anterior y compararlos, explique por qué existen diferencias en estos pesos.
RESULTADOS:
RESULTADOS DE PESOSBALANZA GRANATARIA BALANZA ANALÍTICA
Objeto Peso
¿Por qué hay diferencias?:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
PROCEDIMIENTO 3:
Doblado de vidrio
El vidrio es un líquido sobre enfriado, carente de estructura microcristalina, sin punto de fusión definido, ablandándose dentro de intervalos de temperatura más o menos grandes. El vidrio más empleado en el laboratorio es el pyrex, que se ablanda a temperaturas mayores de 600 °C y su coeficiente de dilatación o expansión es muy bajo. Ordinariamente no se puede trabajar con mechero de Bunsen. Para conexiones y capilares se utiliza el vidrio ordinario y el “Kimble” que son de bajo intervalo de ablandamiento de 400 a 500 °C, por lo que se les puede doblar y estirar usando un mechero de Bunsen.
El tubo de vidrio de diámetro pequeño se puede doblar sin necesidad de soplarlo. Para obtener un tubo doblado correctamente, es indispensable calentar uniformemente en toda la sección del tubo que se va a doblar. Para doblado en ángulo recto, se debe calentar una superficie del tubo de 7 a 8 veces el diámetro del mismo. Esto se logra colocando en la boquilla del mechero una “mariposa” (adaptador triangular). El calentamiento continúa hasta que el tubo comienza a doblarse por su propio peso y la flama se colorea fuertemente de amarillo. La sección que se desea doblar se hace girar constantemente, manteniendo el tubo ligeramente inclinado. Cuando la sección que se va a doblar se
11

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICAhace plástica, se separa el tubo del mechero y se dobla sobre la mesa de trabajo. No lo fuerces pues obtendrá un mal dobles.
Para lo anterior es necesario conocer la llama del mechero, la cual se ilustra a continuación:
Para prender tu mechero, sólo debes seguir los siguientes pasos:
MATERIALES:
No. MATERIAL REACTIVOS1 Mechero bunsen NINGUNO2 Tubo de vidrio
Solicitar al profesor un trozo de tubo de vidrio y doblarlo en ángulo de 90° de acuerdo a las indicaciones del profesor y a las consideraciones teóricas que leíste. Puedes llevarte dicha escuadra.
Realiza los esquemas de la actividad realizada.
12

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
1. ¿Por qué es luminosa la llama del mechero cuando las entradas de aire están cerradas?2. Al abrir las entradas de aire, la luminosidad cambia, explique porqué.3. ¿Qué gas utilizó en el laboratorio?, si tiene olor, explique porque huele.4. ¿Qué reacción ocurre cuando la llama es luminosa (amarilla)?5. ¿Qué reacción ocurre cuando la reacción es más completa (llama de color azul grisáceo)?6. Establezca la diferencia entre una combustión lenta y una combustión viva.
13

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
CONCLUSIONES:
REFERENCIAS EMPLEADAS:
14

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
PRÁCTICA No. 3BASE EXPERIMENTAL DE LA TEORÍA CUÁNTICA
COMPETENCIAS:
1. El alumno identifica las propiedades de un cuerpo negro.2. Comprueba la formación de diversos espectros para diferentes sustancias.
CONSIDERACIONES TEÓRICAS:
Investigue en la bibliografía correspondiente los siguientes conceptos:
A.- Cuerpo negroB.- EspectroscopiaC.- Mecánica cuánticaD.- Fotones
A partir de los conceptos anteriores, realice un mapa conceptual.
MATERIALES:15

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
No.
MATERIAL REACTIVOS
1 LATA PINTADA DE BLANCO CLORURO DE LITIO2 LATA PINTADA DE NEGRO CLORURO DE BARIO3 FOCO CON SU CONEXIÓN CLORURO DE SODIO4 2 TERMÓMETRO CLORURO DE ESTRONCIO5 2 VASO DE PRECIPITADOS CLORURO DE CALCIO6 MECHERO DE BUNSEN CLORURO DE COBRE I7 ASA DE ALAMBRE DE PLATINO CLORURO DE POTASIO8 6 TUBO DE ENSAYO ÁCIDO CLORHÍDRICO9 GRADILLA10 ESPÁTULA11 VIDRIO DE RELOJ12 ETIQUETAS
PROCEDIMIENTO:
I.- Cuerpo negro
1.- Coloca cuidadosamente en una lata blanca y en una lata negra un termómetro cuidando que el bulbo quede en la parte media del cuerpo sin que toque ninguna de las paredes.
2.- Registra la temperatura inicial3.- Acerca a ambos frascos un foco de tal manera que este a la misma distancia de cada uno de ellos.4.- Registra la temperatura de los frascos cada cinco minutos durante media hora.
Tiempo(minutos)
Frascoblanco
Frasconegro
051015202530
5.- Elabora una gráfica con los resultados obtenidos.
II.- Ensayo a la flama
16

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA 1.- Conectar el mechero de Bunsen a la toma de gas y encenderlo
2.- Acercar el asa de platino a la flama del mechero en la parte de oxidación o más caliente hasta que la flama no produzca ninguna coloración.
3.- Enfriar el asa y humedecerla con HCl concentrado.4.- Tomar del tubo de ensayo uno, una pequeña muestra y acércala en la parte de oxidación de la
llama del mechero de Bunsen. Observa el calor que produce en la flama y anótalo en la tabla correspondiente.
5.- Lavar el asa con agua de la llave, luego humedecerla con HCl y tomar una muestra del tubo de ensayo dos. Colocar en la flama y observar el color que se produce anotar en la tabla correspondiente.
6.- Proceder de igual manera que el paso 5 para los tubos restantes.7.- Ilustra los colores observados.
Tubo Sustancia Color de la flama123456
CUESTIONARIO:
1.- ¿Que es un espectro de emisión?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2.- ¿Qué interpretación le dio Sommerfeld a la presencia de líneas al anterior de cada línea de un espectro?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3.- Para formar la bandera mexicana con juegos pirotécnicos ¿Qué sustancias utilizaríamos?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
CONCLUSIONES:
17

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
BIBLIOGRAFÍA:
PRÁCTICA No. 418

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICAOPERACIONES BÁSICAS EN EL LABORATORIO.FILTRACIÓN, DECANTACIÓN, CRISTALIZACIÓN.
COMPETENCIA:
Al término de la práctica el alumno realiza operaciones de filtración, decantación y cristalización identificando los procesos y materiales involucrados.
CONSIDERACIONES TEÓRICAS:
Investigue en la bibliografía correspondiente: Separación de mezclas por filtración, decantación y cristalización. Indique para cada una:
a) Propiedades físicas que interesan para el proceso de separación.b) ¿Qué propiedades tiene el papel filtro? Diferentes diámetros de poro del papel filtro. c) Característica de las sustancias componen la mezcla.d) Otros métodos físicos de separación de mezclas diferentes a los mencionados.
19

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICANo. MATERIAL REACTIVOS1 6 Vidrio de reloj Arena2 6 Espátula agua destilada3 6 Balanza granataria solución saturada NaCl4 1 Balanza analítica Aceite5 1 Chispa ignición 6 6 telas de asbesto.7 6 tripies.8 6 filtro talle largo9 6 soportes universales10 6 capsulas porcelana e mas de 50ml11 6 triángulos de porcelana12 12 anillos de fierro13 6 soporte universal14 6 mecheros de bunsen15 6 probetas de 100 ml.16 18 vasos de pp de 100 ml.17 6 embudos de separación de 500 ml. 18 6 Vidrio de reloj
PROCEDIMIENTO:
I.- Filtración
1. Colocar en un vaso de precipitados 5 gramos de arena2. Agregar 20ml de agua corriente y agitar3. Colocar el embudo de cristal el papel filtro correctamente y vierte el agua con arena4. Identifica las partes obtenidas.5. Realice los esquemas de la operación realizada y sus conclusiones.
II.- Decantación
20

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA1. Colocar en un embudo de separación 20ml de aceite y 70ml de agua corriente.2. Mezclar vigorosamente la mezcla.3. Dejar reposar por 15 minutos la mezcla, sobre un anillo de fierro y separar la capa inferior por
la llave del embudo, recolectando en un vaso de precipitado de 100 ml.4. Medir el volumen obtenido.5. Realiza los esquemas de la operación realizada y anota tus conclusiones.
III.- Cristalización
1. Pesar en balanza granataria la capsula de porcelana2. Medir 30ml de solución saturada de cloruro de sodio.3. Colocar en una cápsula de porcelana.4. Poner a evaporar el líquido, hasta cristalizar la sal de la solución.5. Pesar la capsula de porcelana y por diferencia de peso determinar la masa de la sal obtenida.6. Realiza los esquemas de la operación realizada y anota tus conclusiones.
REFERENCIA EMPLEADAS:
21

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
PRÁCTICA No. 5PERIODICIDAD QUÍMICA
22

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
COMPETENCIA:
El alumno identifica algunas propiedades periódicas de diversos elementos a causa de la variación de sus propiedades químicas.
CONSIDERACIONES TEORICAS:
Investiga los siguientes conceptos:
Periodicidad Metales alcalino térreos, propiedades y métodos de obtención Halógenos propiedades y métodos de obtención
a) Realiza el bosquejo de una tabla periódica que muestre el comportamiento de las diversas propiedades periódicas por grupo y periodo de la misma.
b) Realiza un mapa mental de la información investigada.
Experimento 1”Reactividad química”
No.
MATERIAL REACTIVOS
23

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA1 7 vasos de p.p. de 100 mL 1 gotero con agua de cloro2 1 probeta de 50 mL. 1 gotero con agua de bromo3 7 tubos de ensaye 1 gotero con agua de yodo4 1 gradilla 1 gragea de NaOH5 1 pipeta de 5 mL 1 gragea de KOH6 1 perilla Ca(OH)2
7 Mg(OH)2
8 Agua destilada
PROCEDIMIENTO:
1. Numera los vasos de precipitados y agrega a cada uno 20 mL de agua destilada.2. A continuación, agrega en cada vaso de p.p. 10 gotas de los tres primeros reactivos, uno en cada
vaso, y 0.5 g de los sólidos indicados.3. Realiza la conductividad eléctrica de cada reacción química que efectuaste, observa y anótalo en el
cuadro inferior.4. En siete tubos de ensaye debidamente numerados vierte 4 mL de las sustancias anteriores en el
mismo orden y agrega 5 gotas de tinta china. Anota el tiempo en que tarda en decolorarse la solución. Identifica y reporta la reactividad de las sustancias identificadas.
5. Llena la siguiente tabla en base a las observaciones realizadas:
Sustancia Orden de conductividad Tiempo
Realice los esquemas correspondientes:
De acuerdo con los resultados que obtuviste en las sustancias analizadas, compáralas con las de la tabla periódica.
1. ¿Coincidió el orden de reactividad?
24

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA2. ¿De los elementos que observaste, ¿cuáles tienen similar su comportamiento?¿éste es de acuerdo
al mismo grupo o al mismo periodo?3. De acuerdo a la reactividad química que observaste en los elementos indicados, y apoyado de tu
tabla periódica, pon una flecha en orden creciente de reactividad en los grupos identificados:
Grupo I Grupo II Grupo VIINa Mg ClK Ca Br
I
Experimento 2 “Metales alcalino térreos”
No.
MATERIAL REACTIVOS
1 9 TUBO DE ENSAYO 0.5 g ÓXIDO DE MAGNESIO2 GOTERO 0.5 g ÓXIDO DE BARIO3 PROBETA DE 100 ml 0.5g ÓXIDO DE CALCIO4 GRADILLA 2 ml DE ÁCIDO CLORHÍDRICO CONCENTRADO5 2 CRISTALIZADOR O VASO DE PRECIPITADO 100ml INDICADOR ANARANJADO DE METILO6 2 PIPETA DE 5 ml INDICADOR DE FENOLFTALEÍNA
AGUA DESTILADA
PROCEDIMIENTO
1.- Marcar los tubos de ensayo. En el primero colocar 0.5g de muestra de óxido de magnesio, en el segundo 0.5g de óxido de calcio y en el tercero 0.5g de óxido de bario.
2.- Agregar 5 ml de agua destilada a cada tubo de ensayo con ayuda de una pipeta de 5ml. Agitar vigorosamente y observar si se disuelven o no y anotar resultados en la tabla correspondiente. Dejarlos reposar unos tres minutos.
3.- Cuando se hallan sedimentando los sólidos, verter el líquido sobrenadante en los otros seis tubos de ensayo. Agregar en los primeros tres líquidos decantados una gota de anaranjado de metilo y observar si hay algún cambio en la coloración y anotar los resultados en la tabla correspondiente.
4.- Agregar en los otros tres líquidos decantados, una a dos gotas de solución de fenolftaleína. Observar si hay algún cambio de coloración así como la coloración e intensidad en los tres tubos.
5.- En los tubos que contienen los precipitados insolubles agregar 2 ml de ácido clorhídrico y observar si se disuelven o reaccionan. Anotar resultados en la tabla correspondiente.
6.- Verter un poco de cada uno de los líquidos del punto anterior en los cristalizadores y calentar a fuego bajo hasta que se evapore totalmente el líquido, observar si son sales los cristales o residuos que se forma. Escribir las observaciones en los siguientes renglones:
25

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
OXIDO DE: SOLUBILIDAD REACCIÓN CON HCl
REACCIÓN CON ANARANJADO DE METILO
REACCIÓN CON FENOLFTALEÍNA
BARIOCALCIOMAGNESIO
Experimento 3 “Metales alcalinos”
No.
MATERIAL REACTIVOS
1 CRISTALIZADOR O VASO DE PRECIPITADOS DE 100ml LITIO METÁLICO2 PINZAS PARA CRISOL AGUA DESTILADA3 ESPÁTULA4 PROBETA GRADUADA DE 100 ml
PROCEDIMIENTO:
1.- Cortar cuidadosamente un pequeño trozo de litio con una espátula metálica.
2.- Colocar en el cristalizador 25ml de agua destilada con ayuda de una probeta.
3.- Sujetar con las pinzas para crisol el trocito de litio y colocarlo cuidadosamente en el cristalizador. Observar la reacción que se produce y anotarlos resultados:
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4.- Realizar un dibujo que ilustre el experimento anterior.
Completar las siguientes reacciones:
Li + H2O 26

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
CONCLUSIONES:
BIBLIOGRAFIA:
PRÁCTICA No. 6NOMENCLATURA DE OXIDOS BASICOS E HIDROXIDOS
27

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
COMPETENCIA: Que el alumno repase los principios de la nomenclatura de los óxidos básicos y los hidróxidos. El alumno experimente reacciones que den como productos este tipo de compuestos y que entre
algunos productos comerciales identifique los que entran en esta clasificación.
CONSIDERACIONES TEORICAS
Investigue en la bibliografía correspondiente:
Principios para dar nombre y fórmula química a los óxidos básicos e hidróxidos. Realice un cuadro sinóptico donde describa los pasos a seguir para dar nombre a los compuestos mencionados anteriormente.
Experimento 1
No. MATERIAL REACTIVOS
28

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA1 1 espátula Litio metálico (Li)2 I vidrio de reloj Agua3 1 vaso de precipitado Indicador de Fenolftaleína4 6 tubo de ensayo Indicador de Anaranjado de Metilo5 1 gradilla6 papel filtro
Procedimiento
Saque con papel filtro un trocito de litio, sin tocar, córtelo con la espátula sobre el vidrio de reloj y observe, sobre todo, la superficie donde se efectuó el corte.
Agregue con la espátula el litio, ahora oxidado, a un vaso que contenga 10 ml de agua; observe lo que ocurre.
Cuando termine la reacción, agregue 2 ml de esta solución a cada uno de los tubos de ensayo y guárdelos para el siguiente experimento.
La solución restante dividir en dos tubos y agregar dos gotas de anaranjado de metilo y observe; al otro agregue dos gotas de fenolftaleína y observe lo que ocurre.
Anote sus observaciones: _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Cuestionario
Investigue las reacciones efectuadas y complete las ecuaciones:
Li + O2
Li2O + H2O
¿Cuál es el nombre de los productos de las dos reacciones?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Explique qué ocurrió con el anaranjado de metilo _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Qué ocurrió con la fenolftaleína?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Anote sus conclusiones y realice los dibujos que ilustren el experimento
29

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
Experimento 2
No. MATERIAL REACTIVOS1 pinzas para tubo de ensayo Magnesio2 pinzas para crisol Agua3 2 tubo de ensayo Fenolftaleína4 Mechero Anaranjado de metilo
Procedimiento
1. Tome un trozo de cinta de magnesio con las pinzas para el crisol y llévelo a la zona oxidante del mechero; observe lo que ocurre.
2. Cuando la reacción termine, lleve el producto a un tubo de ensayo que contenga 4 ml de agua y caliente suavemente.
3. Vierta la mitad del líquido en un tubo de ensayo y agregue una gota de anaranjado de metilo y observe; en el otro tubo agregue unas gotas de fenolftaleína y observe lo que ocurre.
Anote sus observaciones y realice esquemas del experimento:
Cuestionario
Investigue las reacciones efectuadas y complete las siguientes ecuaciones:
Mg + O2
Mg + H2O
¿Cuál es el nombre de los productos de las reacciones anteriores?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
30

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
¿Qué ocurre químicamente a un metal cuando reacciona con oxígeno?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Qué ocurre químicamente a un óxido metálico cuando reacciona con agua?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Qué ocurrió con el anaranjado de metilo?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Eso que indica?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Qué ocurrió con la fenolftaleína?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
EXPERIMENTO 3.
No. MATERIAL REACTIVOS1 Cucharilla de combustión Cobre en polvo (Cu)2 mechero de Bunsen
Procedimiento
Tome con la cucharilla de combustión cobre en polvo y llévelo a la zona de oxidación de la flama del mechero, hasta que la reacción termine. Observe que ocurre.
Anote sus observaciones: _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Cuestionario
Investigue la reacción y complete la ecuación que la representa:
Cu + O2
31

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
¿Cómo se llama el producto de la reacción? _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Explique: ¿Por qué esta reacción necesita más calor y no es tan evidente como las de los experimentos anteriores? _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Anote sus conclusiones y realice los dibujos que ilustren el experimento:
Experimento 4
No. MATERIAL REACTIVOS1 4 tubos de ensayo del experimento 1 que contiene hidróxido
de litio5 gotas de solución de cloruro de aluminio al 2 %
2 5 gotas de solución de cloruro férrico al 2 %3 5 gotas de solución de cloruro de cobalto al 2 %4 5 gotas de solución de sulfato de cobre al 2 %
Procedimiento
Tome los tubos de ensayo que apartó en el experimento 1, los cuales contienen hidróxido de litio en solución y agregue a cada uno de ellos de 3 a 5 gotas respectivamente de las siguientes soluciones:Cloruro de aluminio, cloruro de cobalto, sulfato de cobre II y cloruro férrico. Observe lo que ocurre y llene la siguiente tabla:
Sustancia ObservacionesLiOH + AlCl3LiOH +CoCl2
LiOH + CuSO4
LiOH + FeCl3
Cuestionario
Investiga las reacciones y complete las siguientes ecuaciones:
32

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICAAlCl3 + LiOH
CoCl2 + LiOH
CuSO4 + LiOH
FeCl3 + LiOH
Escriba el nombre del producto de las ecuaciones anteriores _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Anote sus conclusiones y realice los dibujos que ilustren el experimento _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Experimento 5
No.
MATERIAL REACTIVOS
1 No es necesario Productos comerciales que sean principalmente óxidos metálicos2 e hidróxidos
Procedimiento
Observe la etiqueta de los productos que se le proporcionan y en función de los datos que aportan, completa la tabla:
No. Nombre comercial Nombre químico Fórmula química1234567
Actividad I
Completa la siguiente la tabla mediante cruce de valencias colocándole nombre a cada compuesto formado:
33

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
Sulfato SO₄⁼
Sulfito SO₃⁼
Fosfito PO₃‴ Fosfato
PO₄‴ Nitrato NO₃⁻
Nitrito NO₂⁻
OxidoO=
HIDROXIDOOH-
CarbonatoCO=
3
K⁺
Li⁺
Mg⁺⁺
Sr⁺⁺
Al⁺⁺⁺
B⁺⁺⁺
Zn⁺⁺
Ca⁺⁺
Cu⁺
Coloca el símbolo según el compuesto de la reacción
a) Cloruro de sodio + nitrato de plomo (II) cloruro de plomo (II) + nitrato de sodio
b) Oxido férrico + acido clorhídrico cloruro férrico + agua
c) Bicarbonato de sodio + acido fosfórico fosfato de sodio + dióxido de carbono + agua
d) Mercurio + oxigeno oxido de mercurio (II)
e) Yoduro de calcio + acido sulfúrico yoduro de hidrogeno + sulfato de calcio
f) Nitrato de bario + acido sulfúrico sulfato de bario + acido nítrico
34

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
g) Cianuro de magnesio + acido clorhídrico cianuro de hidrogeno + cloruro de magnesio
h) Sulfuro de hierro (II) + acido bromhídrico bromuro de hierro (II) + Sulfuro de hidrogeno
i) Sulfito acido de sodio + acido sulfúrico sulfato de sodio + dióxido de azufre + agua
j) Sulfato de aluminio + hidróxido de sodio hidróxido de aluminio + sulfato de sodio
k) Hierro + cloro cloruro de hierro(III)
l) Nitrato de potasio nitrato de potasio + oxigeno
m) Bario + agua hidróxido de bario + hidrogeno
n) Hidróxido de sodio + acido sulfúrico sulfato acido de sodio + agua
o) Sulfuro de amonio + bromuro mercúrico bromuro de amonio + sulfuro mercúrico
CONCLUSIONES:
35

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
REFERENCIAS EMPLEADAS:
PRÁCTICA No. 7NOMENCLATURA DE ANHIDRIDOS, ÁCIDOS Y BASES
36

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
COMPETENCIA:
Que el alumno repase las reglas para dar el nombre y fórmula química a los óxidos no metálicos, ácidos y sales; que experimente con reacciones que se den como productos este tipo de compuestos y que dentro de algunos productos comerciales identifique a los que entran en esta clasificación.
CONSIDERACIONES TEORICAS
Investigue en la bibliografía correspondiente:
Nomenclatura de la I. U. P. A. C. para dar nombre y fórmula química a los óxidos no metálicos, ácidos y sales. Realice un cuadro sinóptico donde describa los pasos a seguir para dar nombre a los compuestos mencionados anteriormente.
Experimento 1
No MATERIAL REACTIVOS
37

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA.
1 Cucharilla de combustión con tapón de corcho 0.1 g de azufre2 Mechero de Bunsen Agua caliente3 Matraz erlenmeyer Anaranjado de Metilo4 Tubo de ensaye5 Gradilla
Procedimiento
Tome 0.1 g de azufre y colóquelo en una cucharilla de combustión , llévela a la zona de oxidación del mechero, cuando observe una flama azul, introduzca la cucharilla en el matraz erlenmeyer que contiene 50 ml de agua de 50° C (SIN QUE TOQUE EL LÍQUIDO) y tape, agite constantemente durante tres minutos. Cuando la reacción termine vierta 2ml en un tubo de ensaye y agregue una gota de anaranjado de metilo para determinar el pH de la solución. Observe lo que ocurre.
Anote sus observaciones_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Cuestionario
Investigue las reacciones efectuadas y complete las siguientes ecuaciones:
S + O2
SO2 + H2O
Anote el nombre de los productos de las reacciones anteriores:_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Con que otros nombres se conocen los óxidos? _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Qué se produce cuando reacciona un óxido no metálico con agua?_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Qué le ocurrió ala solución cuando le agrego anaranjado de metilo? _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Eso que indica?
38

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Anote sus conclusiones y realice los dibujos que ilustren el experimento_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Experimento 2
No.
MATERIAL REACTIVOS
1 1 tubo de ensayo 1 ml de solución de cloruro de bario al 2 %2 2 ml de ácido sulfuroso del experimento 13 2 gotas de solución del indicador anaranjado de metilo4
Procedimiento
En un tubo de ensayo coloque 1 ml de solución de cloruro de bario y agregue 2 ml del ácido sulfuroso preparado en el experimento anterior, agite violentamente durante varios minutos y agregue dos gotas de anaranjado de metilo.
Observe lo que ocurre. Anote sus observaciones: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Cuestionario
Investigue la reacción efectuada y complete la ecuación:
H2 SO3 + BaCl2
Anote el nombre de los productos de la reacción anterior: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Explique cómo en función de la fórmula puede identificar a un ácido y a una sal: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Para que se utilizó el anaranjado de metilo?____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Anote sus conclusiones y realice los dibujos que correspondan al experimento:
39

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Experimento 3
No.
MATERIAL REACTIVOS
1 1 matraz erlenmeyer 5 ml de solución de hidróxido de sodio 0.1 N2 1 gotero Solución de ácido clorhídrico 0.1 N3 1 cápsula de porcelana 1 gota de fenolftaleína4 1 soporte universal5 1 anillo de fierro6 1 tela de asbesto7 1 mechero de Bunsen8 1 bureta9 1 pinza para bureta
Procedimiento
En un matraz erlenmeyer coloque 5 ml de solución de hidróxido de sodio, agregue 1 gota de fenolftaleína y proceda a neutralizar agregando poco a poco y después gota a gota ácido clorhídrico hasta que el indicador vire. Observe lo que ocurre.____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Por último, vierta el contenido del matraz en una cápsula de porcelana y caliente hasta que el agua se evapore totalmente.
Observe el residuo. Anote sus observaciones:____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Cuestionario
Investigue la reacción efectuada y complete la ecuación:
HCl + NaOH
Anote el nombre de los productos de la reacción anterior:____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Qué carácter (ácido ó básico) tienen los productos de la reacción anterior? ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Qué sustancia quedo en el residuo de la cápsula de porcelana después de la evaporación?40

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Anote sus conclusiones y realice los dibujos que correspondan al experimento:
Experimento 4
No.
MATERIAL REACTIVOS
1 6 Tubo de ensayo 1 g de Cloruro de Sodio2 1 g de Bicarbonato de Sodio3 1 g de Sulfato de Amonio4 6 ml de Agua Destilada
1 gota Anaranjado de Metilo1 gota de Fenolftaleína
Procedimiento
Coloque en tres tubos de ensayo 1 g de las siguientes: cloruro de sodio en uno, bicarbonato de sodio en otro y sulfato de amonio en otro. Agregue a cada uno de ellos 2 ml de agua destilada, agite fuertemente. Divida las soluciones en los restantes tubo de ensayo. Agregue una gota de anaranjado de metilo en los primero tres tubos, anotando sus observaciones. Posteriormente agregue una gota de fenolftaleína a los tubos restantes y observe lo que ocurre.
Anote sus observaciones y realice los esquemas correspondientes.
41

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICACuestionario
Explique cuál es la finalidad del experimento____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
De las sales estudiadas. ¿Cuál es ácida? ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Cuál es básica? ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Cuál es neutra? ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Anote sus conclusiones y realice los dibujos que ilustren el experimento:
Experimento 5
No. MATERIAL REACTIVOS1 No necesario Productos comerciales que sean principalmente: óxidos, ácidos o sales
Procedimiento
Observe las etiquetas de los productos que se le proporcionan y en función de los datos que aportan completa la siguiente tabla:
No. NOMBRE COMERCIAL NOMBRE QUÍMICO FORMULA QUÍMICA TIPO DE COMPUESTO
1234567
42

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICAAnote sus conclusiones y realice los dibujos que ilustren el experimento:
Referencias empleadas:
43

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
PRÁCTICA No. 8ENLACES QUÍMICOS
COMPETENCIA: Al término de esta práctica que el alumno en función con las propiedades de una sustancia, determine el enlace y la polaridad de la molécula, que compruebe la Conductividad eléctrica entre compuestos con enlace iónico y enlace covalente, así como algunas otras diferencias entre los enlaces de manera experimental.
CONSIDERACIONES TEÓRICAS:
Investigar los siguientes conceptos:
Enlace químico Tipos de enlace Influencia de enlace químico en las propiedades físicas Electrólito Conductividad eléctrica
Con la información anterior, realice un mapa conceptual correctamente estructurado.
44

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
Experimento I
No.
MATERIAL REACTIVOS
1 4 Vaso de Precipitado 100ml 25 ml de solución de azúcar2 Circuito eléctrico 25 ml de solución de cloruro de sodio diluida3 Espátula 25 ml de ácido clorhídrico4 Vidrio de reloj 25 ml de agua destilada5 Matraz erlenmeyer 250ml6 Mechero de bunsen7 Tripie 8 Rejilla de asbesto9 Embudo de separación 250ml
Procedimiento
En cuatro vasos de precipitados de 100 ml agregue las siguientes soluciones: en el primero, 25 ml de agua destilada; en el segundo, solución de cloruro de sodio; en el tercero, solución de azúcar y en el cuarto, ácido clorhídrico; experimente su conductividad eléctrica introduciendo en el vaso que contiene cada sustancia las barras de cobre, cerrando el circuito eléctrico.
Observe lo que ocurre. Anote sus observaciones
Vaso No.
SOLUCIÓN CONDUCTIVIDAD ELÉCTRICA EXPERIMENTADA
¿SU ENLACE ES POLAR ONO POLAR?
1 Agua destilada2 Solución de cloruro de sodio3 Solución de azúcar4 Ácido clorhídrico
Coloque en un matraz erlenmeyer de 250 ml, 25 ml de agua destilada, 500 mg de ácido benzoico y 250 mg de azúcar morena. Caliente la mezcla anterior si es necesario para facilitar la solubilidad de los componentes anteriores. Enfríe la mezcla a 20° C y pásela a un embudo de separación de 500 ml.
Cuestionario
¿Qué ocurrió con el agua destilada?____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Cómo explica ese fenómeno?____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________¿Qué ocurriría si usara agua de la llave? ¿y porque?____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
45

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
Anote sus conclusiones y realice los dibujos que ilustren el experimento
Experimento 2
No.
MATERIAL REACTIVOS
1 6 Tubo de ensayo de 15 x 150 mm Butanol 2 Gradilla Cloruro de sodio3 Agitador Acido benzoico4 1 pipeta de 10 mL Agua5 1 perilla
Procedimiento
Tome tres tubos de ensayo y coloque una pequeña cantidad de ácido benzoico en uno, cloruro de sodio en otro y acetato de sodio en otro; trate de disolver cada sustancia con agua observe lo que ocurre.Repita el experimento utilizando como disolvente el benceno.
No. SUSTANCIA SOLUBILIDAD EN AGUA si/no
SOLUBILIDAD EN CLOROFORMO si/no
LA SUSTANCIA ES Polar o No polar
1 Acido benzoico2 Cloruro de sodio
Realice los dibujos del experimento realizado:
46

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
Cuestionario 2
En función de su molécula, ¿Qué tipo de solvente es el agua?____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Qué tipo de solvente es el butanol?____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Elabore una lista de cuatro solventes no polares:____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
¿Qué prueba se utilizo en el experimento?____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Anote sus conclusiones y realice los dibujos que ilustren el experimento____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Experimento 3
No.
MATERIAL REACTIVOS
1 3 Crisol de porcelana Azúcar 2 Pinza para crisol Cloruro de sodio3 Mechero de bunsen Almidón 4 Tripie 5 Rejilla de asbesto
Procedimiento
En un crisol de porcelana coloque 2 g de azúcar, sostenga el crisol con las pinzas y acérquela a la flama del mechero durante 3 minutos, observe lo que ocurre.
Repite el experimento, pero ahora con cloruro de sodio posteriormente con almidón. Observe lo que ocurre en cada caso.
Anote sus observaciones:
47

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Cuestionario:
¿Qué prueba que observo con el experimento?____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
En los espacios vacíos complete lo que se le pide
No.
SUSTANCIA SE FUNDIÓ SI/NO QUE TIPO DE ENLACE TIENE POLAR/ NO
POLAR1 Cloruro de sodio2 Azúcar3 Almidón
Anote sus conclusiones y realice los dibujos que ilustren el experimento____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Experimento 4
Con base en las investigaciones bibliográficas y en los experimentos anteriores complete la siguiente tabla:
No.
PROPIEDAD DE LA SUSTANCIA POLAR NO POLAR
1 Estado físico2 Puntos de fusión y ebullición3 Conductividad eléctrica4 Fuerzas de enlace5 Fuerzas intermoleculares
Responda correctamente las siguientes cuestiones:
1. CONTESTA BREVEMENTE a) ¿Qué es el enlace químico?b) ¿porqué los aniones tienen mayor volumen que los átomos neutros?c) ¿Cuándo se forman un doble enlace y da un ejemplo?d) Da 5 ejemplos de sustancias que en estado liquido conducen la corriente eléctrica
2. INDICA EL TIPO DE ENLACE DE LAS SUSTANCIAS
a) CH4
b) LiBrg) H2Oh) NH3
48

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICAc) SO2
d) CO2
e) KClf) MgO
i) HClj) AgFk) Kll) BaO
3. REPRESENTA CON ESTRUCTURA DE LEWIS LOS SIGUIENTES AGREGADOS ATÓMICOS
a) CH4
b) CO2
c) FeS
d) Cl2
Elabore una lista de 3 compuestos polares y 5 no polares
COMPUESTOS POLARES COMPUESTOS NO POLARES______________________________ ________________________________________________________________ ________________________________________________________________ __________________________________
____________________________________________________________________
REFERENCIAS EMPLEADAS:
49

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
PRÁCTICA No. 9ESTEQUIOMETRÍA I. “EFICIENCIA DE UNA REACCIÓN Y FÓRMULA MÍNIMA”
COMPETENCIA
El alumno aplica las relaciones cuantitativas implícitas en una reacción química para determinar la eficiencia de una reacción y encontrar la fórmula mínima de un compuesto.
ANTECEDENTES:
Nota: Con la siguiente información realice un mapa conceptual.
Pureza de los reactivos:
La pureza de los reactivos es fundamental para la exactitud que se obtiene en cualquier análisis. En el laboratorio se dispone de distintos tipos de reactivos (sólidos, líquidos o disoluciones preparadas) tal y como se comercializan. En general, las casas comerciales ofrecen un mismo producto con varias calidades. Es importante que cuando seleccionemos un reactivo su calidad esté en concordancia con el uso que se le va a dar.
En el laboratorio de análisis se utilizan reactivos de calidad analítica que se producen comercialmente con un alto grado de pureza. En las etiquetas de los frascos se relacionan los límites máximos de impurezas permitidas por las especificaciones para la calidad del reactivo o los resultados del análisis para las distintas impurezas. Dentro de los reactivos analíticos pueden distinguirse tres calidades distintas:
Reactivos para análisis (PA): Son aquellos cuyo contenido en impurezas no rebasa el número mínimo de sustancias determinables por el método que se utilice.
Reactivos purísimos: son reactivos con un mayor grado de pureza que los reactivos “para análisis”. Reactivos especiales: Son reactivos con calidades específicas para algunas técnicas analíticas,
como cromatografía líquida (HPLC), espectrofotometría (UV)…
Hay reactivos que tienen características y usos específicos como los reactivos calidad patrón primario,se emplean en las técnicas volumétricas, o los patrones de referencia.
Eficiencia de una reacción:
En los procesos químicos, todos los reactivos, no se convierten en productos, ya sea por: errores de medición o de peso, formación de sustancias no deseadas, etc. Por ello, la cantidad de productos de
50

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICAuna reacción, siempre va a ser menor de lo que se esperaba en teoría. Para obtener el rendimiento se utiliza la siguiente formula.
% Rendimiento = (Cantidad real / cantidad teórica) X 100
En el caso que nos den el % de rendimiento, suponemos que la cantidad que se tiene de los elementos es el 100% y tenemos que obtener el 70%.
Por ejemplo:
Un proceso para generar NO (monóxido de nitrógeno) de manera económica, consiste en quemar amoniaco gaseoso. Tomando en cuenta que la reacción presenta un rendimiento del 70% y que se alimentan 300 kg de amoniaco, calcula según la siguiente reacción:
NH3 + O2 -----------------------> NO + H2O
a)La cantidad real en moles de oxígeno requerida.
b)La masa en kg de monóxido de nitrógeno formado.
Balanceamos la ecuación:
4NH3 + 5O2 ----------------> 4NO + 6H2O
Para obtener el primer inciso, tenemos que:
1 mol (NH3) X 17 kg/mol = 17 kg (NH3)
1mol (NH3) --------------17kg(NH3)4mol (NH3) -----------------------X
X= 68 kg (NH3)
68 kg (NH3) ------------------ 5 mol (O2)300 kg (NH3) ------------------X
X= 22.05 mol
Este resultado es lo que obtenemos si el rendimiento es al 100%, pero como se está trabajando al 70% el rendimiento, así que debemos de obtener la cantidad de moles que se obtiene realmente:
22.05 mol -----------100%...X............-----------70%
X= 15.441 mol (valor real de moles obtenidas)
Para el inciso "b", se tiene:51

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
1mol ( 30kg/mol) = 30kg (NO)
1 mol(NO)----------------30kg (NO)4 mol(NO)----------------X
X= 120kg (NO)
5mol (O2)-----------------120kg(NO)15.441mol(O2)-----------X
X= 370.584 kg (NO)
Pureza
En algunos procesos químicos, los reactivos, no están completamente puros, sino que tienen cierto grado de impurezas. Por ejemplo si se dice que se tiene 100kg de carbonato de calcio con un 83 % de pureza, de los 100kg de materia prima, 83 kg son de carbonato de calcio y los 17 kg restantes son impurezas (agua, cenizas, metales, etc.)
Por ejemplo:
En la siguiente ecuación química:
NaOH + CuCl2---------->Cu(OH)2 + NaCl
considera que se utilizan 80kg de cloruro cúprico con un 75% de presa, calcula:
a. La masa en kg de hidróxido cúprico producido.b. Las moles de hidróxido de sodio que reaccionaron
Primero balanceamos la ecuación:
2NaOH + CuCl2 -------------------> Cu(OH)2 + 2NaCl
Decimos que de los 80 kg de cloruro cúprico (CuCl2), solo el 75% de esta cantidad es CuCl2 y el 25% restante son impurezas, entonces obtenemos la cantidad real de CuCl2 que se tiene:
100%---------------80kg75%-----------------X
X = 60kg
Si decimos que tenemos 134.5 kg de CuCl2 ( pues 1 mol X 134.5 kg/mol= 134.5kg de CuCl2) y tenemos 97.5 kg de Cu(OH)2 (pues 1mol X 97.5 kg/mol = 97.5 kg de Cu(OH)2), con 60 kg de CuCl2, cuantos kg de Cu(OH)2 tendremos.
134.5 kg (CuCl2)-------------97.5 kg (Cu(OH)2)60 kg (CuCl2)------------------X
X = 43.49
52

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
Para el inciso "b", podemos deducir que si con 134.5 kg de CuCl2 tenemos 2 mol de NaOH, con 60kg de CuCl2, cuantos mol de NaOH tendremos:
134.5 kg (CuCl2)------------2 mol (NaOH)60kg (CuCl2)-----------------X
X = 0.892 mol de (NaOH)
Formula mínima y Formula verdadera:
La fórmula mínima es la que me dice la cantidad relativa de átomos que se encuentra en la molécula. La verdadera, me dice la cantidad real.
Ejemplo:
CH3O es la fórmula mínima (me dice que por cada átomo de C hay 3 de H y 1 de O)C2H6O2 es la verdadera, o molecular, y me indica la cantidad real que hay de cada átomo en la molécula.
MATERIALES:
No.
MATERIAL REACTIVOS
1 Balanza analítica Zinc en polvo2 Cápsula de porcelana Ácido clorhídrico 6 N3 Espátula 4 Soporte universal con anillo de fierro5 Pinzas para crisol6 Rejilla de alambre con asbesto7 Probeta de 100 ml8 Mechero de Bunsen o 1 parrilla eléctrica9 Desecador10 Balanza Analítica
Procedimiento
1. Pesar una cápsula de porcelana vacía. Registrar este peso como mc. 2. Pesar en una balanza analítica 500 mg de zinc en polvo dentro de la cápsula de porcelana
anterior.3. Con las pinzas para crisol, quitar la cápsula de la balanza analítica y adicionar 10 ml de ácido
clorhídrico 6 N, calentar suavemente la mezcla con el mechero de Bunsen o parrilla eléctrica (use la campana de extracción) hasta que el zinc se disuelva totalmente; en cuanto esto ocurra aumente la llama o el calor de la parrilla hasta evaporar el exceso de ácido clorhídrico.
4. Cuando solo quede un residuo blanco en la cápsula, suspender el calentamiento y dejar enfriar la cápsula en el desecador. Una vez fría, pesar en la balanza analítica y registrar este peso como m1
Resultados
Calcule la masa del residuo por la diferencia de m1 y mc.53

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
Calcule la fórmula mínima del residuo de la siguiente tabla:
No. ELEMENTO No. ATÓMICO
ATOMOS g RELACIÓN SUBÍNDICE FÓRMULA MÍN.
1 Zn 65 0.5/65 =
2 Cl 35.5 Mr – 0.5/35.5 =
Observaciones:____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Cuestionario:
¿Qué sustancia es el residuo blanco y cuál es su fórmula química?____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Compare la fórmula real con la fórmula mínima determinada experimentalmente. ¿Cómo resultaron?____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Completa y balancea la reacción efectuada entre el zinc y el ácido clorhídrico.
Conclusiones:
REFERENCIAS CONSULTADAS:
54

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
PRÁCTICA 10:ESTEQUIOMETRIA II.- “PESO EQUIVALENTE”
COMPETENCIA
El alumno determina de manera experimental el peso equivalente de una sustancia basándose en los datos experimentales obtenidos.
CONSIDERACIONES TEÓRICAS
Investigar los siguientes conceptos:
Ley de proporciones recíprocas o equivalentes Peso equivalente de un elemento Peso equivalente de un compuesto
Con la información investigada, realice un mapa conceptual.
55

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
Experimento 1
No. MATERIAL REACTIVOS1 Balanza Granataria Sulfato de cobre2 Probeta de 50 ml Limadura de fierro3 Espátula Agua destilada4 Estufa Solución Jabonosa5 2 Vaso de precipitados6 Mechero de Bunsen7 Pinzas para crisol8 Soporte universal 9 Agitador de vidrio10 Vidrio de Reloj11 Rejilla 12 Anillo de fierro
Procedimiento:
Determinar en la balanza granataria, lo más exacto posible, la masa de un vaso de precipitados de 250 ml, sin retirar del plato, agregarle 5g de CuSO4 y determinar la masa total. Registrar estos datos:
No. CONCEPTO PESO1 Vaso de p.p. de 250 ml vacío2 Vaso de p.p. de 250 ml con CuSO4
1. Pesar en la balanza granataria otro vaso de p.p. de 250 ml y añadirle 1.0g de limadura de fierro.2. Precise la masa de la limadura y registre estos datos:
No. CONCEPTO PESO1 Vaso de p.p. de 250 ml vacío2 Vaso de p.p. de 250 ml con limadura de fierro
Al vaso uno (CuSO4), agregar 25 ml de agua y calentar hasta disolver los cristales completamente. Una vez disuelto el CuSO4,se suspende el calentamiento y se vierte lentamente la limadura de fierro; espere a que disminuya la reacción producida. Observe y esquematice lo que ocurre.
56

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
Dejar el vaso en reposo para que se enfríe y agregar 2 gotas de solución jabonosa, así se evitarán las partículas en la superficie. Después separar con cuidado el líquido transparente. Introduzca en la estufa el vaso con el sólido para secarlo, una vez seco y frio determinar la masa del producto:
No. CONCEPTO PESO1 Vaso de p.p. de 250 ml con producto seco2 Producto
Observaciones e ilustraciones:
Conclusiones:
Cuestionario
1. Complete y balancee la reacción efectuada:
CuSO4 + Fe
2. Cuantos gramos o miligramos de cobre se obtuvieron experimentalmente:___________________
3. Cuál es el reactivo limitante:________________________________________________________
4. Cuál es el reactivo en exceso y cuanto reacciona de este:________________________________
57

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA5. Realiza el cálculo teórico de cuanto cobre se produce y compara los resultados con el producto
experimental; si existen diferencias, explica a que se deben:
REFERENCIAS CONSULTADAS:
58

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
ANEXO I:
Diversos materiales de laboratorio:
59

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
60

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
61

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICA
62

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICAANEXO II:
Diversos dispositivos de laboratorio:
Dispositivo de destilación: Dispositivo de filtración:
Dispositivo de titulación: Dispositivo de extracción:
Dispositivo de reflujo: Dispositivo para destilación por arrastre de vapor:
ANEXO III
63

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICATABLA DE CATIONES Y ANIONES
64

TECNOLÓGICO DE ESTUDIOS SUPERIORES DE COACALCOINGENIERÍA QUÍMICA
LABORATORIO DE QUÍMICAREFERENCIAS CONSULTADAS:
Patiño Jaramillo, Margarita. Química básica: prácticas de laboratorio. Instituto Tecnológico Metropolitano. Dirección Fondo Editorial. Colombia. Consultado el 28 de agosto de 2012 de la URL http://books.google.com.mx/books?id=BZPfj8pN8iwC&printsec=frontcover&source=gbs_ge_summary_r&cad=0#v=onepage&q&f=false.
Cruz Alejandro; Muñoz Herrera Alejandro; Jiménez Rodríguez, Amelia R.; Rizo Zúñiga, Benito, et.al. Química General Aplicada: Manual de Laboratorio. UPIBI. IPN. Agosto 2006. Consultado el 24 de agosto de 2012 de la URL:http://www.comunidades.upev.ipn.mx/UPIBI/Documentos%20compartidos/Materiales%20de%20Pr%C3%A1cticas/Manual%20de%20Pr%C3%A1cticas%20de%20Qu%C3%ADmica%20General%20Aplicada.pdf.
Osorio Giraldo, Rubén Darío. Manual de Técnicas de Laboratorio Químico. Colección ciencia y Tecnología, Medellín Colombia. 2009. Consultado el 24 de agosto de 2012 de la URL: http://books.google.com.mx/books?id=vv_w_FC4vNUC&printsec=frontcover&source=gbs_ge_summary_r&cad=0#v=onepage&q&f=false
De Anda, Cárdenas, Pascual; Jara Castro, Sandra; Vivas Arceo, Ma. del Refugio; Flores de León, Herminia y Rodríguez Bautista Ma. de los Angeles. Química 2.Umbral Editorial, S.A. de C.V. Zapopán Jalisco, México. Consultado el 20 de agosto de 2012 de la URL http://books.google.com.mx/books?id=1bvEJPkLfI0C&pg=PA217&lpg=PA217&dq=practicas+periodicidad+quimica&source=bl&ots=r9GgY1vli_&sig=HbJxYRD6EZhx1k4ZmV4ZJvzXvz8&hl=en&sa=X&ei=eyw8UJXTBcLY0QGoz4GwDg&ved=0CDAQ6AEwAQ#v=onepage&q=practicas%20periodicidad%20quimica&f=false.
65







![Pureza de maria[1]](https://static.fdocuments.co/doc/165x107/559238681a28ab4a158b47bc/pureza-de-maria1.jpg)







![Pureza Pizzas Caseras-2[1]](https://static.fdocuments.co/doc/165x107/55cf8aac55034654898cdec6/pureza-pizzas-caseras-21.jpg)


