MICROBIOLOGÍA DE SUELOS Técnicas, métodos y...
Transcript of MICROBIOLOGÍA DE SUELOS Técnicas, métodos y...

UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
2004
M. en C. María de Jesús Sánchez
MICROBIOLOGÍA DE SUELOS
Técnicas, métodos y medios de cultivo

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
MICROBIOLOGIA DE SUELOS Técnicas, métodos y medios de cultivo
M. en C. MARÍA DE JESÚS SÁNCHEZ COLÍN

MICROBIOLOGIA DE SUELOS Técnicas, métodos y medios de cultivo ISBN: 970-32-1907-1
D.R. © 2004 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
Prohibida su reproducción total o parcial con fines de lucro.
PAPIME: EN216403

CONTENIDO Página
I
INTRODUCCION
1
II
MATERIAL DE USO COMÚN EN MICROBIOLOGÍA DE SUELOS
3
2.1
EL MICROSCOPIO
3
2.2 PROBETAS DE CULTIVO 5 2.3 CAJA PETRI 5 2.4 PIPETAS BACTERIOLÓGICAS 5 2.5 EL ASA Y LA AGUJA PARA INOCULAR 5 2.6 PORTAOBJETOS 5
III ESTERILIZACION DEL MATERIAL
7
3.1 ESTERILIZACION CON CALOR SECO 7 3.1.1.- La Incineración 7 3.1.2. La Tindalización 7 3.2 ESTERILIZACIÓN POR FILTRACIÓN 7 3.2.1- Flujo Laminar 8 3.3 ESTERILIZACION CON CALOR HÚMEDO 8 3.4 ESTERILIZACION POR RADIACIONES 9 3.5 SOLUCIONES PARA ESTERILIZAR 10
IV CONSIDERACIONES PARA AISLAR A LOS ORGANISMOS
11
4.1 ESTERILIZACION 11 4.2 PREPARACION DE MEDIOS DE CULTIVO 11
V MEDIOS DE CULTIVO SINTÉTICOS
13
5.1 CULTIVOS PUROS EN PLACA 14 5.2 PLACA ESTRIADA 14 5.3 METODO DE DILUCIÓN DE SUELO SERIAL 14 5.4 CULTIVOS EN TUBO CON AGAR INCLINADO 16
VI TECNICAS DE INOCULACIÓN
17
6.1 INOCULACION PRIMARIA 17 6.2 INOCULACION EN CALDO 18

6.3 INOCULACIÓN EN AGAR INCLINADO PARA CONSERVACION DE CEPAS
18
VII
TECNICAS MICROSCÓPICAS
19
7.1 MONTAJE EN SOLUCIÓN SALINA 19 7.2 MONTAJE EN HIDROXIDO DE POTASIO 19 7.3 TECNICA DE LA GOTA PENDIENTE 19 7.4 TECNICA DE LA TINTA CHINA 19 7.5 METODO DEL HEMATOCITOMETRO CALIBRADO 20 7.6 METODO DE ROSSI Y CHOLODNY 20 7.7 MEDICIÓN DE MICROORGANISMOS 21
VIII TINCIONES DIRECTAS
23
8.1 TINCION DE GRAM 23 8.2 TINCIONES ACIDORRESISTENTES O DE ZIEHL-NEELSEN 24 8.3 TINCIONES SELECTIVAS 25
IX AISLAMIENTO DE BACTERIAS
27
X
AISLAMIENTO DE ACTINOMICETOS
33
XI
AISLAMIENTO DE HONGOS
37
XII
AISLAMIENTO DE ALGAS
43
XIII
AISLAMIENTO DE PROTOZOARIOS
45
XIV
AISLAMIENTO DE NEMATODOS
49
XV BIBLIOGRAFÍA
53

I .- INTRODUCCIÓN
Entre todas las ciencias que estudian seres vivos, la Microbiología es, probablemente, la única que se ocupa de todos los aspectos relativos a los organismos que constituyen su objeto de estudio. Se trata, por tanto, de una biología general de los microorganismos, entendiendo por tales aquellos organismos que son invisibles al ojo humano, sin ayuda de un instrumento óptico que amplíe su imagen, y que son o bien unicelulares o bien pluricelulares pero con una organización biológica muy simple. Por consiguiente, la Microbiología se ocupa tanto del estudio de las características inherentes a los microorganismos (tales como su estructura celular, su bioquímica, su fisiología y su genética, entre otras), como de sus actividades y sus interacciones con otros seres vivos y con el medio en el que habitan. Entre estas últimas se encuentran aquéllas características que tienen que ver con el papel de los microorganismos como transformadores de la materia orgánica e inorgánica (y, por tanto, con la participación de los microbios en los ciclos de los elementos en la naturaleza), así como aquéllas que hacen que muchos de ellos se comporten como agentes patógenos de animales y vegetales, aspectos todos ellos de indudable interés en agronomía.
La Microbiología del suelo no es una disciplina pura ya que sus orígenes pueden buscarse en la Bacteriología, la Micología y la Edafología además de la Bioquímica y la Fitopatología. Estas disciplinas se entrelazan para formar la Microbiología del suelo y se debe estar familiarizado en cierta medida con sus principios para poder entender e interpretar todos los fenómenos que suceden dentro del suelo y el impacto que tienen en el medio ambiente y en particular en la agricultura.
En el suelo existe una gran variedad de organismos que realizan muy diversas funciones que ejercen influencias benéficas y perjudiciales sobre la capacidad de alimentación del hombre y la calidad del medio ambiente entre los cuales podemos citar a los hongos, bacterias, actinomicetos, algas, protozoarios, nematodos y virus. Para realizar un análisis de los organismos edáficos es necesario llevar a cabo una serie de técnicas básicas y experimentales que nos permitan conocer su morfología, hábitos, fisiología, en general su biología así como la forma de extracción. Para el estudio de estos microorganismos se necesita conocer aprender y familiarizarse con los métodos básicos de extracción de los mismos; por ello este manual se divide en dos partes, la primera trata los aspectos generales donde se hace mención del material, reactivos, técnicas básicas y experimentales de uso común para iniciarse en estudios de Microbiología de suelos. En la segunda parte se menciona las características generales de la microbiota del suelo , los medios específicos y la manera de aislarlos. Este manual va dirigido a los alumnos de la carrera de Biología, para que se inicien en la información básicas necesaria para poder realizar estudios microbiológicos. Es un recopilación de métodos y técnicas que se utilizan en estudios de microbiología básica y microbiología de suelos.

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 2
II.- MATERIAL DE USO COMÚN EN MICROBIOLOGÍA DE SUELOS 2.1.- EL MICROSCOPIO Una de las herramientas del microbiólogo más útil es el microscopio óptico, ya que todas las formas vivientes con las que se experimentan son invisibles a simple vista y es indispensable que se este familiarizado con el microscopio al iniciar un estudio en el laboratorio de microbiología. En la actualidad existen dos tipos de microscopía: 1).- Microscopía óptica y 2).- Microscopía electrónica. En la microscopía óptica la imagen se amplifica por una serie de lentes desde 100 a 1000 diámetros y en algunos casos hasta 2000 según el tipo de luz y la forma de iluminar el objeto en estudio. Puede ser de campo claro, de campo oscuro, de contraste de fases, de fluorescencia y de ultravioleta. Sin embargo, el más utilizado en estudios microbiológicos es el de campo claro. La microscopía electrónica amplifica la imagen mediante un haz de electrones en lugar de luz y un campo magnético (que hace la veces de los lentes), produciendo imágenes con aumentos de doscientos mil a cuatrocientos mil diámetros. Los microscopios pueden ser simples o compuestos según el número de lentes con que cuenten; los microscopios simples utilizan un solo lente y el microscopio compuesto tiene dos o más lentes. Los compuestos son los que se utilizan en este tipo de estudio y ellos cuentan con dos sistemas de lentes que son el ocular y el objetivo donde el ocular amplifica la imagen producida por el objetivo. La mayor parte de los microscopios compuestos tienen varios objetivos los cuales pueden ser tres y cada uno de ellos proporciona una resolución diferente (Burges, 1990). El objetivo de menor poder aumenta el objeto 10 veces, el objetivo de mayor poder amplificando la imagen 40 veces aproximadamente y el objetivo de aceite de inmersión amplifica el objeto 90 veces como el ocular aumenta 10 veces la resolución total combinada es de 100, 400 y 900 respectivamente (Locquin, 1985). Se debe considerar los detalles del microscopio para obtener mejores resultados al utilizarlo, como conocer el sistema de control, tipo de platina (fija o con movimiento), localización del diafragma, tipo de luz, etc., (ver figura 1). La forma correcta para enfocar el microscopio es muy importante y por ello es necesario que se sigan estas indicaciones para poder lograrlo: __ Usar el tornillo macrométrico para que descienda el objetivo hasta que este tan cerca del portaobjetos o preparación como sea posible observando en forma lateral el descenso para que el lente no toque el portaobjetos. En su descenso el objetivo de bajo poder no toca la preparación pero él de alto poder y él de inmersión si pueden tocarlo. __ Observar a través‚ del ocular y empezar a enfocar subiendo el objetivo hasta lograr el mejor foco posible.

Microbiología de Suelos 3
__ Se debe utilizar primero el objetivo de bajo poder para lograr el foco óptimo y luego cambiar al objetivo de alto poder y mover el tornillo micrométrico‚ para obtener el nuevo foco óptimo de inmediato. __ Es necesario mantener limpios los lentes para que la imagen no este borrosa. __ No usar el lente de inmersión en seco o bien el objetivo de alto poder con aceite pues mancha el lente y provocaría su desprendimiento.
OCULARES
REVOLVER
OBJETIVO
PLATINA
DIAFRAGMA
BASE
TORNILLOS Macrométrico y Micrométrico
BRAZO
CONDENSADOR
Figura 1 .- Partes básicas de un microscopio compuesto de campo claro

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 4
2.2.- PROBETAS DE CULTIVO La probeta de cultivo o el tubo de ensayo común tiene una gran variedad de usos en el laboratorio de Microbiología pero principalmente se utiliza para cultivar microorganismos en medios artificiales; generalmente se cubren con un tapón de algodón pero también‚ los hay con tapas de acero inoxidable tapón de hule o plástico y tapón de rosca (baquelita). Al estar utilizándolas se debe flamear la boca del tubo con un mechero Bunsen para destruir los microorganismos que se puedan acumular en el tubo o probeta antes de inocular con los organismos que se desea estudiar. 2.3.- CAJA PETRI Las cajas Petri pueden ser de vidrio o plástico y proporcionan un espacio cerrado en el cual crecen los organismos en cultivos artificiales; pueden contener alrededor de 15 mL de medio sólido y se deben incubar en posición invertida. La técnica correcta de sembrar una caja Petri con agar nutritivo para colonias aisladas se debe colocar en la mano izquierda abriéndola con el dedo pulgar formando un ángulo de apertura pequeño y si esté se realiza por cuadrantes se debe girar la caja 90 sacando el asa y cerrar la caja Petri para sembrar la siguiente zona. 2.4.- PIPETAS BACTERIOLÓGICAS Las pipetas se utilizan para transferir de un recipiente a otro cantidades exactas de liquido en condiciones de asepsia pueden ser de 1 mL y 10 mL. 2.5.- EL ASA Y LA AGUJA PARA INOCULAR Se utilizan para transferir microbios para cultivo de un recipiente a otro en condiciones asépticas y con ello evitar la introducción de organismos no deseados, estos dispositivos consisten en un mango al cual se le une un alambre de platino o nicromo, el alambre puede ser recto (aguja) o puede terminar en asa, al utilizarlos se deben esterilizar colocándolos a la flama de un mechero Bunsen hasta que se torne rojo, luego se deja enfriar de 10 a 15 segundos y se toman los organismos para transferirlos en forma aséptica a otro recipiente. 2.6.- PORTAOBJETOS El tipo más común es el portaobjetos simple de vidrio, pero los hay cóncavos (con una depresión circular en el centro), para observar bacterias vivas o bien de pozo profundo para microcultivos de mohos y hongos microscópicos (Granados, 1998).

Microbiología de Suelos 5
III.- ESTERILIZACION DEL MATERIAL En las técnicas usadas en Microbiología, el material con que se trabaja necesita de una asepsia que se logra con el proceso de esterilización. Mediante este método se logra matar microorganismos o esporas que pueden interferir en nuestro estudio provocando contaminación en los cultivos o infecciones en los organismos, los principales métodos de esterilización son: el calor seco en hornos, el calor húmedo en autoclave, las radiaciones con luz ultravioleta o rayos X y agentes químicos. 3.1.- ESTERILIZACION CON CALOR SECO El calor seco o aire caliente se recomienda siempre que el vapor de agua a presión no sea deseable o que no sea posible que entre en contacto directo con el material que se va a esterilizar. Con esté método se coagulan las proteínas que forman parte del citoplasma celular al elevarse la temperatura ambiental. Se recomienda su uso con el material de vidrio y todo aquello que no se queme con altas temperaturas que van de 160 º C a 180 º C como máxima. Para realizar este tipo de esterilización se hace uso de estufas u hornos con termostato que regulen la temperatura durante 1 o 2 horas. Para el manejo adecuado de un horno, se debe considerar lo siguiente: La transferencia del calor a los materiales debe ser homogénea. Se debe precalentar el horno. El tiempo se cuenta a partir de que el horno llega a la temperatura de 180 º C. No abrir el horno hasta que se complete la esterilización. Abrir por debajo de los 70 º C, debido a que un enfriamiento brusco podría romper los objetos de vidrio. 3.1.1.- La Incineración.- es un método de esterilización eficaz, pero su aplicación es muy limitada. En este se emplea la llama roja de un mechero para esterilizar el asa de siembra, que sirve para transferir microorganismos de un lugar a otro, además se pueden esterilizar espátulas y objetos contaminados como los desechos de hospitales y cadáveres de animales de laboratorio. 3.1.2. La Tindalización.- Este método se utiliza para sustancias que se desnaturalizan a temperaturas de 100 º C, para ello se usa la autoclave con la válvula abierta o un vaporizador de Arnold. Se esteriliza de manera continua por tres días y se deja incubar después de cada esterilización, de tal manera que en la primera esterilización se destruyen las estructuras que están en latencia y al dejarse incubar algunas estructuras como las esporas germinan. Con el segundo y tercer periodo de calentamiento se eliminan estas formas vegetativas. 3.2.- ESTERILIZACIÓN POR FILTRACIÓN Esta técnica se emplea para esterilizar sustancias termolábiles, como sueros, vitaminas, antibióticos, azucares, entre otros. El material filtrante puede ser de asbesto, tierra de diatomeas, porcelana y actualmente se usa las membranas de éster de celulosa. La eliminación de los contaminantes bióticos, esta en función de la carga eléctrica y del tamaño de los poros

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 6
del material filtrante. Para su aplicación se debe usar material estéril y se coloca el material filtrante sobre el soporte de la unidad de filtración, se fija y se pasa el líquido a través de la membrana o material filtrante, recolectándose el filtrado en un matraz esterilizado. Además estos filtros se utilizan para esterilizar el aire ambiental de sitios que lo requieran (Fig. 2). 3.2.1- Flujo Laminar.- Es una técnica que permite controlar la contaminación que proviene del aire, mediante dos procesos simultáneos: 1).- El paso del aire a través de filtros absolutos ( HEPAVECOFLOW que retiene partículas de 0.3 micras) y 2).- Regulación de la velocidad del aire filtrado y dirección del mismo. Los dispositivos que aplican esta técnica son las campanas de flujo laminar horizontal y vertical, que se utilizan en actividades que requieren esterilidad.
3.3.- ESTERILIZACION CON CALOR HÚMEDO Este método se dice que mata o destruye todos los microorganismos ya que al penetrar más rápidamente el calor transportado por la humedad, el punto de coagulación desciende y este calor se distribuye más uniformemente que el calor seco, con una aplicación de 5 a 10 minutos a 100 º C, mueren todas las formas celulares y de 15 a 20 minutos a 120 º C mueren las esporas. Los aparatos para lograr esta esterilización son el esterilizador de Arnold y el autoclave. El esterilizador de Arnold se recomienda solo para medios de cultivo de gelatina, leche o medios carbohidratados, pero no es muy efectivo para la destrucción de esporas, ya que no garantiza que todas las esporas germinen en el momento de la esterilización para que mueran a una temperatura de 100 º C. El uso de la autoclave es el método más recomendado para la esterilización del material de vidrio y medios de cultivo que se usarán o medios de cultivo que se van a desechar. Para cantidades pequeñas puede utilizarse con cierta seguridad las ollas de presión de uso doméstico. A continuación se muestra la relación entre la presión de vapor y la temperatura, pero esto depende de la expulsión previa del aire del recipiente durante el periodo de purgación.
Entrada del líquido
Material de Porcelana
Filtro de Porcelana
Tierra de diatomeas
Filtro Berkefield
Figura 2.- Equipos de esterilización por filtración

Microbiología de Suelos 7
Presión de vapor en libras
(mayor que la presión atmosférica)
Temperatura º C
0 100.0 5 108.3 10 115.5 20 126.6
No es posible dar instrucciones detalladas para los distintos tipos de autoclaves pero a continuación se menciona algunas indicaciones para utilizar una unidad controlada manualmente. 1.- Asegurarse de que la tapa del autoclave este perfectamente cerrada antes de generar o introducir calor 2.- Permitir que el vapor salga en forma libre y continua durante varios minutos a fin de expulsar todo el aire del autoclave antes de cerrar la espiga. 3.- Cuando la presión haya actuado durante el tiempo requerido, ciérrese la fuente de calor a vapor y déjese enfriar el autoclave hasta que la presión indicada por el manómetro sea de 0 atmósferas. 4.- En este momento y no antes abrase la espiga lentamente y quítese luego la tapa. 3.4.- ESTERILIZACION POR RADIACIONES Las radiaciones como la luz ultravioleta y los rayos X provocan la muerte en los organismos celulares, debido a la destrucción de los ácidos nucleicos de los microorganismos además de formar peróxido en el medio celular, los cuales actúan como agentes oxidantes, retarda su desarrollo y modifica sus características hereditarias provocando mutaciones. Este tipo de radiaciones provoca la muerte de virus, bacteriófagos, esporas, hongos y bacterias. Todo el material fuera del envase esterilizador es portador de microorganismos y se debe impedir su entrada, para lo cual los envases se tapan antes de la esterilización a fin de impedir la posterior entrada de gérmenes, para tal efecto se utilizan tapones de algodón, tapas metálicas o de vidrio. Cuando se procede a la apertura de los envases, debe realizarse rápidamente de manera de reducir el tiempo de exposición y de protegerlos en todo lo posible contra la entrada de partículas provenientes del aire (García, 1991)
Tabla 1 .- Presión de vapor y temperatura del autoclave

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 8
3.5.- SOLUCIONES PARA ESTERILIZAR Se deben preparar soluciones esterilizantes que se utilizan para limpiar las mesas de trabajo antes de efectuar el aislamiento del microorganismo o bien también pueden ser utilizadas para tratar la superficie del tejido vegetal del cual se va aislar el organismo en estudio, estos pueden ser raíz, semilla, hojas y tallo. Estas soluciones actúan como limpiadores superficiales para eliminar o reducir contaminantes. Los compuestos esterilizantes que se utilizan con mayor frecuencia son: Solución de hipoclorito de sodio al 5 %. Alcohol etílico al 95%. Solución de cloro al 10%. Cloruro de mercurio en la proporción de 1:1000 en solución acuosa (Tóxico). Solución Rada. (Cloruro de mercurio 1:1000 en alcohol etílico al 50%) (tóxico). En estas soluciones se debe enjuagar el material en estudio y posteriormente enjuagarse con agua estéril (Agrios, 1991; Koneman, 1997).

Microbiología de Suelos 9
IV.- CONSIDERACIONES PARA AISLAR A LOS ORGANISMOS Para realizar un diagnóstico de los microorganismos presentes en el suelo o en tejidos vegetales, es necesario observarlos al microscopio, para ello hay que aislarlos, pero como se encuentran mezclados con una gran variedad de organismos o contaminantes es necesario aplicar diferentes métodos para aislar al o los organismos deseados a fin de llevar a cabo un estudio de sus características, hábitos, reproducción, etc. Para ello se deben llevar a cabo los siguientes procedimientos preliminares: 4.1.- ESTERILIZACION La esterilización del material de cristalería, agua y medios de cultivo, se realiza mediante la utilización de la autoclave. 4.2.- PREPARACION DE MEDIOS DE CULTIVO Los organismos vivos requieren de sustancias nutritivas o nutrientes para sintetizar su material celular, generar energía y llevar a cabo su fisiología. En el laboratorio de Microbiología se han diseñado medios de cultivo, que son mezclas de agua, sustancias orgánicas e inorgánicas en cantidades variables, que tratan se simular la composición química de las células y los nutrientes que requiere para su desarrollo. De tal manera que los principales nutrientes son el hidrógeno, oxígeno, carbono, nitrógeno, fósforo y azufre en orden decreciente, además de algunos cationes de sales inorgánicas como el potasio, calcio, magnesio y hierro y en requerimientos pequeños el manganeso, cobalto, cobre, molibdeno y zinc (Ramírez-Gama, et al., 2003). Algunos microorganismos requieren de compuestos orgánicos específicos como vitaminas, aminoácidos, purinas o pirimidinas, que funcionan como precursores de otros nutrientes (factores de crecimiento), por ello al preparar o elegir un medio de cultivo se debe considerar lo siguiente: Tener una mezcla equilibrada de todos los nutrientes. Controlar el pH. Evitar la precipitación de sales minerales. La preparación de medios de cultivo, los cuales pueden ser muy variados según los tipos de organismo que se quieran aislar. Algunos son sintéticos con cantidades conocidas de compuestos químicos y por lo común son medios específicos. La mayoría contiene un extracto de una fuente de carbohidratos y otros nutrientes como papa, harina de maíz, habas o extracto de malta y se les agrega agar para que solidifique el medio donde se van a desarrollar los microorganismos.

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 10
Los medios de cultivo que se utilizan con mayor frecuencia son: PAPA-DEXTROSA (PDA).- El cual es un medio general para aislar a la mayoría de hongos. AGAR-AGUA o AGAR-GLUCOSA.- Se mezcla de 1 a 3 gr. de glucosa en agar - agua, este medio se utiliza para separar hongos como Pythium y Fusarium de bacterias. AGAR NUTRITIVO.- Este medio debe contener peptona y extracto de carne, es útil para aislar bacterias. Los hongos pueden aislarse en medios de cultivo de bacterias al añadir 1 o 2 gotas de una solución de ácido láctico al 25%, el cual inhibe el crecimiento de bacterias, está solución también se puede agregar a todo el medio antes de vertirse en las cajas Petri en una cantidad de 10 mL/L Los medios de cultivo se preparan en matraces, se tapan y se esterilizan en autoclave a 120 º C y a 15 libras de presión durante 20 minutos, al enfriarse se vacían en las cajas Petri o tubos de ensayo en forma aséptica en un lugar limpio y libre de corrientes de aire y polvo.

Microbiología de Suelos 11
V.- MEDIOS DE CULTIVO SINTÉTICOS La utilización de un medio de cultivo se realiza para estudios donde se quiera determinar el tipo y abundancia del microorganismo en su ambiente y el aislamiento de una cepa particular de su ambiente natural aumentando el número de individuos de una especie . Esta técnica se utiliza para seres microscópicos y nos permite conservar los organismos en condiciones de estudio, por tiempo prolongado. El medio de cultivo se considera como el soporte favorable de crecimiento de los microorganismos, ya que reúne las características necesarias indispensables para el tipo de organismos como son: nutrientes, pH, temperatura, aireación, y otros factores especiales según el organismo de que se trate. Si se realizan estudios metabólicos es necesario conocer con precisión los componentes del cultivo, pero muchos microorganismos de vida libre crecen bien en estos medios que tienen las características básicas antes mencionadas, pero si son parásitos que se desarrollan en cultivos específicos, se tiene que tener cuidado en elegir el medio de cultivo para su óptimo desarrollo. Se pueden preparar medios de cultivo sólidos, semisólidos y líquidos; los sólidos proporcionan la facilidad de que los organismos se desarrollen por separado y los líquidos se emplean con frecuencia para permitir la competencia y en consecuencia la selección máxima, aun cuando el organismo que se obtiene al final del proceso haya estado en cantidades ínfimas junto con otros organismos. Es más común el uso de medios de nutrientes sólidos que contienen agar y un agente gelificante en la preparación de éste tipo. El agar solidifica formando un gel transparente el cual no puede ser metabolizado por la mayoría de microorganismos y se mantiene firme hasta muy cerca de los 100 º C; una vez derretido se mantiene liquido hasta cerca de los 40 º C (Granados, 1998). Los medios de cultivo se pueden clasificar de acuerdo a su aplicación en: Selectivos.- son los que favorecen el desarrollo de un microorganismo específico y suprime el crecimiento de otro, por ejemplo la adición de cloruro de sodio en altas concentraciones, lo hace selectivo para los estafilococos y algunas bacterias Gram positivos y suplrime a otras sensibles a esta sal. Enriquecidos.- son los que permiten el desarrollo de microorganismos heterótrofos exigentes en nutrientes, como los que se preparan con caldo enriquecidos con sangre, suero o extractos de animales o vegetales. Diferenciales.- estos contienen sustancias indicadoras que ponen de manifiesto alguna actividad metabólica del microorganismo que es diferente a los demás. En el medio Agar sangre se puede hemolizar (destruir) los glóbulos rojos, con la acción de las bacterias hemolíticas , ya que forman una zona clara alrededor de la colonia bacteriana. Cuantificación.- para determinar la cantidad de microorganismos y la calidad microbiológica del agua y leche, entre otros, usando formulaciones y medios específicos. Caracterización.- Son variables y se usan para determinar tipo de crecimiento, características metabólicas del microorganismo. Mantenimiento.- se utilizan para preservar la viabilidad de las células en un cultivo y se caracterizan por tener concentraciones muy limitadas de nutrientes.

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 12
5.1.- CULTIVOS PUROS EN PLACA Los métodos para obtener los mejores cultivos puros son los de placa. El cultivo en placa consiste en mezclar una suspensión de células (diluidas en agua estéril) en agar fundido a 45 º C y vaciarlo en cajas Petri, cuando el agar se solidifica las células se inmovilizan en este y crecen formando colonias, donde cada una se pudo haber formado a partir de una célula única. Posteriormente se toma la colonia en estudio y se prepara una suspensión con ella y se resiembra en otra placa repitiendo esto varias veces se puede obtener un cultivo puro. Esta técnica presenta problemas ya que no todos los organismos se desarrollan en forma independiente y se complica el poder separar las colonias para llevarlas a medios subsecuentes por ello se hace uso de otra técnica como el de la placa estriada. 5.2.- PLACA ESTRIADA Para preparar una placa estriada se usa la impregnación de una sola asada de material en estudio como podría ser suelo, agua , etc. sobre la superficie de un medio de agar ya solidificado y el tipo de estría sobre el agar es muy variado como se observa en la figura 3. Después de realizar la inoculación por el método deseado, las cajas Petri se incuban a la temperatura que se requiera para su desarrollo en posición invertida para evitar que el agua de condensación que se forma en la caja Petri se deposite sobre la superficie del medio, provocando que las colonias de bacterias se junten y sea imposible decir donde empieza y termina una de ellas.
Figura 3. Diferentes métodos de estriado
5.3.- METODO DE DILUCIÓN DE SUELO SERIAL El método de dilución o del número más probable permite calcular la densidad microbiana sin una enumeración directa, el crecimiento de los organismos empieza después de la inoculación
Inoculación primaria Estría en ángulo recto Estría en dos cuadrantes

Microbiología de Suelos 13
de volúmenes conocidos en series de diluciones decimales de suelo en medio nutritivo, siempre que el inoculó contenga una o más células. Por lo tanto, si el crecimiento ocurre en la dilución 10-5 y no en la dilución de 10-6 , la población de este tipo de microbiano se considera entre 10-5 y 10-6 . La cuantificación se logra repitiendo la inoculación 5 o más veces con cada dilución en los medios nutritivos, luego se registra en que dilución hubo crecimiento y se hace el cálculo de acuerdo a la cantidad de suelo utilizada inicialmente para conocer el número más probable de microorganismos considerando que cada colonia fue originada por una célula (Echegaray, 1993) . Esta técnica consiste en preparar una solución patrón de suelo, la cual se va diluyendo de la siguiente manera: 1.- Todo el proceso se realiza en condiciones asépticas y con material estéril. 2.- En 90 mL de agua estéril se colocan 10 gr. de suelo y se agita por 10 minutos (solución patrón 1:10). 3.- Se toma 1 mL de esta solución patrón y se mezcla con 9 mL de agua estéril en un matraz de 50 mL y se resuspende la solución 1:100. 4.- Se repite el paso anterior con la solución 1:100 y así sucesivamente hasta obtener la dilución deseada. 5.- Por último se inocula 1 mL de la dilución deseada sobre una caja Petri con agar antes de que solidifique, se incuba y se espera el desarrollo de colonias y se calcula el número de ellas de acuerdo a la dilución utilizada, para conocer el número más probable (Fig.4).
Figura 4.- Método de dilución de suelo serial

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 14
5.4.- CULTIVOS EN TUBO CON AGAR INCLINADO Los microorganismos pueden cultivarse en tubos con solución nutritiva disuelta en agua, siempre y cuando la superficie del medio este en contacto con el aire en forma adecuada. Esto se logra derritiendo el agar en la probeta o tubo y dejando que solidifique en forma inclinada, a esto se le conoce como agar inclinado, pero en otras ocasiones se prefiere tener la probeta con agar, sin inclinar y se le conoce como agar vertical.

Microbiología de Suelos 15
VI.- TECNICAS DE INOCULACIÓN El material para la inoculación es relativamente simple, se recomienda un alambre de nicromo o platino recto o en forma de asa, el cual se inserta en un mango y sobre la superficie del agar solidificado se puede inocular la muestra mediante varios métodos de estriado ya mencionados anteriormente (Johnson, 1992). 6.1.- INOCULACION PRIMARIA El inoculó primario se puede efectuar con una asa, un hisopo o con otro dispositivo una vez realizado el inoculó primario, se puede emplear un alambre recto o con asa a fin de diseminar el material en los cuatro cuadrantes de la placa y el inoculó se disemina sucesivamente en estrías con un movimiento de arriba hacia abajo en cada cuadrante dando vuelta la placa y esterilizando el asa en la flama para cada estriado diferente (Fig. 5). El propósito de esta técnica es diluir el inoculo suficientemente sobre la superficie del agar como para obtener colonias bien aisladas a partir de unidades formadoras de colonias. Estas ya aisladas se pueden subcultivar individualmente en otros medios a fin de obtener cultivos puros. La técnica de estrías empleada para inocular medios de agar es útil en el recuento semicuantitativo de colonias (Granados, 1998).
Figura 5.- Técnica de inoculación primaria.

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 16
6.2.- INOCULACION EN CALDO Los medios de cultivo se pueden distribuir en tubos, ya sea como caldo o en agar sólido; también se puede utilizar agar semisólido en pruebas de movilidad, pero los tubos con caldo se pueden inocular inclinando el tubo a un ángulo de aproximadamente 30 grados y acercar un asa con el material a inocular a la superficie interior del vidrio, justo sobre el punto en el que la superficie del medio forma un ángulo agudo. Cuando el tubo de cultivo se vuelve a la posición vertical, el área de inoculación queda sumergida debajo de la superficie (Fig.6).
Figura 6 .- Inoculación de un tubo con caldo. 6.3.- INOCULACIÓN EN AGAR INCLINADO PARA CONSERVACION DE CEPAS Los tubos que contienen agar inclinado se inoculan primero atravesando el agar en profundidad y se continua sembrando por estrías la parte inclinada desde abajo hacia arriba, con un movimiento en "S", luego de retirar el alambre de la parte profunda(Fig. 7).
Figura 7.- Inoculación en tubos de agar inclinado

Microbiología de Suelos 17
VII.- TECNICAS MICROSCÓPICAS Se conocen varias técnicas que pueden ser utilizadas en el examen directo de muestras o colonias de organismos que se desarrollan en medios de cultivo, ya sea para demostrar la presencia de microorganismos u observar ciertas características bioquímicas, fisiológicas o serológicas (Koneman, 1997). Las técnicas más comunes empleadas en el laboratorio de Microbiología son: 7.1.- MONTAJE EN SOLUCIÓN SALINA Se utiliza una solución de cloruro de sodio acuoso al 0.85% y nos sirve para determinar la actividad biológica de microorganismos, como la movilidad. Sobre un portaobjetos se coloca una gota de solución salina y sobre de ella se suspende una pequeña cantidad de la muestra, colocar el cubreobjetos y examinar al microscopio, observándola a inmersión. Para evitar la desecación, rodear el cubreobjetos con una mezcla de parafina-vaselina antes de colocar la gota de muestra sobre el portaobjetos. 7.2.- MONTAJE EN HIDROXIDO DE POTASIO Se utiliza KOH al 10 % en solución acuosa, el cual ayuda a observar con mayor claridad los hongos, para ello se suspende en una gota de KOH la muestra, luego se coloca encima el cubreobjetos y se deja asentar a temperatura ambiente durante media hora o bien la preparación se puede calentar suavemente en la flama de un mechero para acelerar el proceso de aclaramiento y posteriormente se examina al microscopio. 7.3.- TECNICA DE LA GOTA PENDIENTE Esta técnica tiene el mismo propósito que el montaje en solución salina, que es observar la movilidad en bacterias, para ello se coloca una pequeña cantidad de la mezcla de parafina - vaselina alrededor del borde de la concavidad de la superficie superior de un portaobjetos de gota pendiente. En el centro del cubreobjetos suspender la muestra en una gota de agua o solución salina, invertir el portaobjetos y presionarlo sobre el cubreobjetos guiando la gota de suspensión hacia el centro de la cavidad, luego volver con cuidado el portaobjetos a la posición normal para el examen microscópico directo. 7.4.- TECNICA DE LA TINTA CHINA Para esta técnica se utiliza tinta china (marca Pelikán) y los gránulos finos de la tinta constituyen un fondo semiopaco contra el cual se puede observar claramente las cápsulas o quistes de muchos microorganismos. Si la muestra es líquida se debe centrifugar ligeramente para concentrar a los microorganismos, se emulsiona sobre un portaobjetos una pequeña cantidad de muestra en una gota de tinta

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 18
china y luego se coloca el cubreobjetos. Dicha emulsión no debe ser muy espesa, pues puede bloquear la luz al observar al microscopio. 7.5.- METODO DEL HEMATOCITOMETRO CALIBRADO Para realizar un examen microscópico directo de las colonias en el suelo se utiliza este método, que consiste en la incorporación de una cantidad de suelo en agar líquido colocando unas gotas de esta infusión en un hematocitómetro calibrado, la suspensión se tiñe y luego es observada al microscopio. Si se conoce la cantidad de suelo, el volumen de agar y el área sobre la cual este distribuido, puede determinarse el número de bacterias en la muestra. 7.6.- METODO DE ROSSI Y CHOLODNY Se conoce como el método del portaobjetos enterrado o portaobjetos de contacto de Rossi y Cholodny, fue el primero en utilizarse en estudios de las características de la población microbiana del suelo en relación con su medio ambiente, esté método no es cuantitativo sino cualitativo; se utiliza para estudios de laboratorio y campo. Las limitaciones del método es la incapacidad para aislar y cultivar las células microbianas observadas a través del microscopio, para realizar esta técnica se hace lo siguiente: * Estudio en campo.- Se coloca de 4 a 6 portaobjetos en el campo, introduciéndolos en la región más cercana a las raíces, durante un periodo de 15 a 30 días, pasado este tiempo se remueven con cuidado de no destruir el frotis formado sobre el portaobjetos y se sigue este procedimiento. 1.- Lave ligeramente el frotis con agua para eliminar las partículas gruesas del suelo y déjelo secar al aire libre. 2.- Se tiñe con el siguiente colorante, cuya composición es: Rosa de bengala...................... .....1.0 g Cloruro de calcio dihidratado..............0.1 g Fenol al 5% acuoso.................... .100.0 mL 3.- Se deja con el colorante 10 minutos sin dejarlo secarse. 4.- Se lava y seca al aire libre. 5.- Se observa al microscopio la forma y tamaño de las células bacterianas y forma de las colonias, presencia de filamentos de Actinomicetos, hongos, esporas, algas o algún otro organismo. * Estudio en laboratorio.- Se pesan tres porciones de 200 gramos de muestra de suelo tamizado y se colocan en vasos de precipitados de 500 mL, se agrega agua hasta 40 a 50% de la capacidad de campo, luego se insertan 2 portaobjetos en cada vaso, se cubren con papel no poroso o con cajas Petri para evitar la evaporación rápida del agua, se deja incubar a temperatura ambiente durante 15 días y se remueve un portaobjetos y el otro se retira a los 30 días, con el fin de compararlos, siguiendo el proceso antes mencionado para su observación microscópica ( Echegaray, 1993).

Microbiología de Suelos 19
7.7.- MEDICIÓN DE MICROORGANISMOS En muchos estudios microbiológicos se requiere conocer el tamaño del microorganismo con el que se realiza la investigación, ya que las bacterias tienen dimensiones entre 0.2 a 10 µm, los eucariotes miden de 2 a 40 µm; esporas de hongos de 10 a 200 µm, entre otros, por ello se requiere de una medición de los mismos, de manera indirecta al observarlos, para lo cual se utilizan: Un ocular micrométrico que sustituye al ocular del microscopio y que tiene una escala arbitraria, pero con divisiones lo suficientemente pequeñas como para medir microorganismos. Un objetivo micrométrico que es un portaobjetos en el cual está grabada una fina escala dividida en centésimas de milímetro; es decir, que cada una de sus divisiones mide 10 µm. Para calibrar el micrómetro ocular, se colocan en los respectivos sitios del microscopio el ocular micrométrico y el objetivo micrométrico, se enfoca y se hacen las coincidir las líneas iniciales de ambas escalas, se localiza alguna división en la que vuelvan a coincidir las escalas exactamente y se calcula la equivalencia en micras de cada división del ocular, sabiendo que cada división del objetivo mide 10 µm (Ramírez-Gama, et al., 2003).

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 20
VIII.- TINCIONES DIRECTAS Debido a que las bacterias y otros microorganismos son pequeños y su protoplasma posee un índice de refracción cercano al del agua, se requiere de tinciones biológicas, para visualizar o demostrar el fino detalle de sus estructuras internas. Las tinciones se llevan a cabo con soluciones acuosas u orgánicas de colorantes o mezclas de colorantes, que confieren una variedad de colores a los microorganismos, tejidos animales o vegetales y a otras sustancias de importancia biológica. Los colorantes no sólo sirven para la tinción directa de materiales biológicos, sino que también se pueden emplear a fin de demostrar las funciones fisiológicas de los microorganismos empleando las llamadas técnicas supravitales. Los colorantes sirven asimismo como indicadores de cambio de pH en los medios de cultivo y como indicadores redox, para demostrar la presencia o ausencia de condiciones anaerobias. La mayoría de los colorantes biológicos son derivados del alquitrán, poseen anillos bencénicos en especial como derivados de la anilina y fenilamina. La clasificación de los colorantes está basada en los cromóforos presentes formando dos grupos, el de los colorantes "ácidos" y el de los colorantes "básicos", términos que nos indican si una parte significativa de la molécula es aniónica o catiónica. Desde el punto de vista práctico, los colorantes básicos tiñen estructuras de naturaleza ácida como la cromatina nuclear de la célula y los colorantes ácidos reaccionan con sustancias básicas tales como la estructura citoplasmática. Si en una preparación se deben teñir las estructuras nucleares y citoplasmáticas, se puede emplear una combinación de colorantes ácidos y básicos; un ejemplo común son las tinciones con hematoxilina (básica) y eosina (ácida) empleadas para examinar cortes de tejidos (Locquin, 1985). Las coloraciones más comunes son las técnicas de Gram y de Ziehl-Neelsen. La aplicación de diferentes colorantes y la combinación de colorantes, mordentes y decolorantes, han permitido desarrollar diversas clases de tinciones, que pueden ser: Tinciones simples Tinciones diferenciales Tinciones simples.- consisten en aplicar un solo colorantes a la preparación para observar la morfología de los microorganismos. Se usan principalmente colorantes básicos como el azul de metileno, el cristal violeta o la safranina. Tinciones diferenciales.- consiste en aplicar una combinación de colorantes, mordentes y decolorantes que permiten poner de manifiesto alguna diferencia importancia en la composición de los microorganismo. De este modo, se pueden distinguir microorganismos que, aún cuando presentan igual morfología 8.1.- TINCION DE GRAM El método de Gram es ampliamente utilizado en la tinción de bacterias, ya que es un factor importante en la taxonomía de ellas, sobre todo de algunas especies patógenas. El carácter taxonómico consiste en la respuesta del microorganismo a la coloración y se conocen dos

Microbiología de Suelos 21
grupos por su diferente reacción tintórea ante la coloración de Gram los cuales son: la bacterias Gram-Positivas y las Gram-Negativas. En esta técnica se utiliza el cristal violeta o violeta de genciana que actúa como colorante primario, que se une a la pared celular bacteriana luego de un tratamiento con una solución débil de yodo. Algunas especies de bacterias debido a la naturaleza química de su pared celular, poseen la capacidad de retener él cristal violeta aun después del tratamiento con decolorantes orgánicos (mezcla de acetona-alcohol), tales bacterias se denominan Gram-Positivas. Otras bacterias las llamadas Gram-Negativas pierden la coloración primaria del cristal violeta al ser tratadas con decolorantes debido a un mayor contenido de lípidos en su pared celular y mediante la aplicación de un colorante secundario como la safranina adquieren un color rosado o rojo vistas al microscopio habiendo fijado la safranina como contracolor a su pared celular y se realiza de la manera siguiente: * Cubrir el frotis ya fijado con solución de cristal violeta durante un minuto, luego se deja escurrir el exceso del colorante. * Lavar gota a gota con agua de la llave, cubrir el frotis con lugol durante un minuto. * Escurrir y lavar con agua de la llave o destilada. * Inclinar el portaobjetos y agregar gota a gota una mezcla de acetona al 30% en alcohol etílico para decolorar, aproximadamente 15 segundos. * Lavar con agua de la llave gota a gota. * Cubrir con safranina en solución al 2.5% en alcohol del 95% durante un minuto. * Lavar con agua, escurrir y dejar secar al aire * Observar al microscopio y determinar si es Gram-positiva (se tiñe de color violeta) o Gram-negativo (se tiñe de color rojo). 8.2.- TINCIONES ACIDORRESISTENTES O DE ZIEHL-NEELSEN Las microbacterias poseen una cápsula gruesa y cerosa resistente a la tinción, sin embargo, una vez teñidas la cápsula resiste a la decoloración con potentes solventes como el alcohol y el ácido. Por tal motivo los microorganismos que tienen esta propiedad se les llama acidorresistentes. A fin de que el colorante primario (Carbolfucsina) logre penetrar las cápsulas cerosas de los bacilos acidorresistentes, se requiere de un tratamiento físico como es la aplicación de calor después‚ de haber aplicado el colorante de cabolfucsina a la muestra. Otras tinciones que se utilizan son la Azul de Metileno de Loefflere como coloración simple en una gran variedad de microorganismos, en donde se tiñen intensamente los gránulos metacromáticos, diferenciándose del citoplasma que adquiere un color azul claro. También se

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 22
usa el Lactofenol Azul de Algodón, como contracolor para tejidos sin fijar, bacterias y protozoos; además en la actualidad se usa para tinción directa de micelio fúngico y cuerpos fructíferos que toman un color azul claro (Moreno, 1988). 8.3.- TINCIONES SELECTIVAS Este tipo de tinción nos permiten observar un organelo celular determinado, ya que el colorante se combina selectivamente con él. Para lograrlo se usan mordentes, agentes acidificantes o precipitantes y de contraste, las importantes son:
Tinción de endosporas, Tinción de flagelos, Tinción de núcleo y Tinción de cápsula.
Tinción de endospora.- las endosporas son organeros de resistencia de algunas
bacterias y se producen dentro de la célula. Tienen una capa externa muy resistente formada por complejos de calcio, ácido dipicólinico y peptidoglucano, muy difícil de colorear, por ello se debe emplear una tinción acidorresistente, en donde se tiñe con fucsina fenicada en caliente y luego se aplica un colorante de contraste para distinguir a la espora.
Tinción de flagelo.- los flagelos son estructuras que están constituidos por una
sustancia llamada flagelina, son muy pequeños, ya que su espesor va de 10 a 30 µm, no son vistos en el microscopio óptico, por ello se tiñen para aumentar su grosor. Se utiliza ácido tánico como mordente, que precipita sobre los flagelos al teñirse con para-rosa-anilina y el colorante de contraste usado es el azul de metileno, para teñir el resto de la célula, no se fija a la flama. Los flagelos de organismos eucariotes, como algas y protozoarios son más gruesos y se pueden observar con tinciones simples.
Tinción de núcleo.- el núcleo contiene a los cromosomas, los cuales se pueden teñir
con métodos como el de Feulgen o Giemsa-HCL. El HCL reduce la afinidad del citoplasma (RNA) por el colorante y aumenta la afinidad del núcleo por el mismo. Observando al núcleo bien teñido y el citoplasma en color claro. También se puede utilizar una solución diluida de azul de metileno, que tiene afinidad por los ácidos nucleicos y no se fija a la flama, pues se precipitarían todas las proteínas.
Tinción de cápsula.- este organelo es una cubierta extracelular constituida por
polisacáridos, que se acumula alrededor de la célula, puede ser muy gruesa y no se combina fácilmente con colorantes y para observarse se utiliza la tinción negativa, usando la tinta china o nigrosina para oscurecer el fondo.

Microbiología de Suelos 23
IX.-AISLAMIENTO DE BACTERIAS El número de bacterias en el suelo es grande pero los individuos son pequeños y constituyen menos de la mitad de la masa celular microbiana total. Taxonómicamente las bacterias se ubican según el Manual de Bergey (1988) en grupos donde se consideran sus característica fisiológicas, nutricionales y metabólicas, así como el tipo de energía que utilizan para realizar su metabolismo como podría ser el uso de carbohidratos, nitrógeno, etc. La morfología celular también sirve para caracterizar a las bacterias, las cuales pueden ser bacilos, cocos y espirilos (poco comunes en el suelo). Algunos bacilos producen endosporas que permanecen en estado latente en condiciones adversas, otras especies poseen estructuras que también se toman en cuenta como son la presencia de flagelos y posición de los mismos. La cantidad y tipo de bacterias están determinadas en gran medida por el tipo de suelo, humedad, aireación, temperatura, pH, cantidad de materia orgánica, profundidad, prácticas de cultivo y estación del año. Por lo general el número de bacterias es mayor en zonas cultivadas que en zonas vírgenes, ya que el cultivo favorece las condiciones para la proliferación de las mismas (Alexander, 1990; Sprent, 1990)). Los géneros de bacterias que aparecen comúnmente en placas de agar con suspensión de suelo diluido son: Acinetobacter, Agrobacterium, Bacillus, Clostridium, Corynebacterium, Micrococcus, Mycobacterium, Pseudomonas, Sarcina, Staphylococcus, Streptococcus y Xantomonas. Además de Azotobacter, Nitrobacter, Nitrosomona, Aerobacter, Azospirillum, y Rhizobium. Los géneros Bacillus y Clostridium son formadores de endoesporas. De todos los géneros antes mencionados que aparecen en placas de agar son del 5% al 60% de Artrobacter del 7% al 67% de Bacillus, del 3% al 15% de Pseudomonas, 20% de Agrobacterium y menos del 5% lo representan los otros géneros.
Figura 8.- Bacteria común que se encuentra en el suelo Pseudomonas sp. (foto de Alexander, 1990)

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 24
Para aislar las bacterias del suelo hay que realizar el método de dilución de suelo serial y posteriormente sembrar en el medio de cultivo que se requiera para el estudio, incubando a una temperatura óptima para el desarrollo de estas bacterias. Revisar periódicamente el cultivo hasta que aparezcan las primeras colonias, las cuales se podrán observar a través del microscopio óptico utilizando las técnicas del montaje en solución salina, gota pendiente y para conocer la abundancia de ellas en el suelo, realizar un conteo en placa o bien mediante el método del hematocitómetro calibrado. Para conocer su ubicación taxonómica se inicia con la elaboración de una preparación fija por el método de Gram y luego se realizan los cultivos puros para posteriormente sembrar en medios específicos para observar que tipo de metabolismo realizan como podría ser la producción de ácidos que actúan como fermentadores de algunos compuestos carbohidratados, características que nos ayudan a conocer su ubicación taxonómica. A continuación se mencionar la composición de algunos medios de cultivo que se utilizan con mayor frecuencia en el estudio de bacterias (ver cultivos de bacterias Fig. 9). Para la preparación de los medios se deben disolver las sustancias en agua destilada caliente, añadir el agar y calentar; normalmente se esteriliza a 15 libras de presión durante 20 minutos. Antes de que se enfríe el medio se vierte en las cajas Petri junto con el inoculo y se espera a que solidifique para incubar de 3 a 4 días a la temperatura de 28ºC a 30ºC o en algunos casos particulares puede variar, para que se desarrollen las colonias bacterias (Mac-Faddin, 1984; Rickwood, 1997; Singleton, 1997).
MEDIO DE AGAR-EXTRACTO DE SUELO Agar 15.0 g K2 HPO4 0.4 g (NH4)2 HPO4 0.5 g Mg SO4.7H2O 0.05 g MgCl2 0.1 g Fe Cl3 0.01 g CaCl2 0.1 g Peptona 1.0 g Extracto de levadura 1.0 g Extracto de suelo 250 mL Agua destilada 750 mL
Se ajusta a pH 7.4
Para ajustar el pH se utiliza NaOH, KOH y HCl 1 N, según se requiera.
MEDIO DE GELOSA SIMPLE (MEDIO GENERAL)
Extracto de carne 1.0 g Peptona 1.0 g Agar-agar 4.0 g Agua destilada 200 mL

Microbiología de Suelos 25
MEDIO NFB SOLIDO (Azospirillum) Ácido málico 5.0 g K2HPO4 0.5 g Fe-EDTA (Solución 1.64%) 4.0 g Na2 MoO4.2H2 O 0.001 g MnSO4.2H2 O 0.002 g MgSO4 .H2 O 0.2 g NaCl 0.1 g CaCl.2H2 O 0.026 g Extracto de levadura 1.0 g Agua destilada 1000 mL
Ajustar a pH 7 con KOH, esterilizar a 15 libras durante 15 minutos, verter a las cajas Petri con el inoculo e incubar de 2 a 3 días a 32 º C. Son bacilos cortos y ligeramente curvos Gram-negativos y una movilidad en forma de espiral, se forma una especie de nata en el medio o película fina blanquecina en la superficie del mismo.
AGAR-EXTRACTO DE LEVADURA DE MANITOL ROJO CONGO (Rhizobium)
Manitol 10.0 g Extracto de levadura 0.2 g K2 HPO4 0.5 g MgSO4 .7H O 0.2 g NaCl 0.1 g CaCO3 3.0 g Rojo congo (Sol. acuosa al 1 %) 2.5 mL Agar 20.0 g Agua destilada 1000 mL
Ajustar a un pH de 7 y esterilizar a 15 libras de presión durante 20 minutos, incubar a 28 º C de 4 a 7 días, apareciendo en el medio como colonias blanquecinas sobre el medio rojo.
MEDIO DE CULTIVO PARA Nitrosomonas MgSO4 .7H2 O 0.1 g NaHCO3 0.5 g Na2 HPO4 13.5 g KH2 PO4 0.7 g FeCl3 .6H2 O 0.014 g CaCl2 .2H2 O 0.18 g (NH4 )2 SO4 0.5 g Agua destilada 1000 mL
Esterilizar a 15 libras de presión durante 20 minutos e incubar a una temperatura de 25-28 º C durante 24 días. Para la cuantificación de Nitrosomonas se utiliza el reactivo de Griess-llosvaye que se compone de las soluciones A/B/C.

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 26
Solución A.- Disolver 0.6 g de ácido sulfanilico en 70 mL de agua destilada caliente; se enfría la solución y se agrega 20 mL de HCl concentrado, diluir esta mezcla en 100 mL con agua destilada. Solución B.- Agregar 0.6 g de a-Naftilamina en 10-20 mL de agua destilada y agregar 1 mL de HCl concentrado, diluir y aforar a 100 mL con agua destilada. Solución C.- Disolver 16.4 g de CH-COONa.3H2 O (acetato de sodio) en 100 mL de agua destilada. Se guardan por separado las soluciones en frasco ámbar y en refrigeración. Para la identificación de la presencia de Nitrosomonas se añaden tres gotas del reactivo de Griess-llosvay al tubo de cultivo, la aparición de un color rojo indica la presencia de nitritos.
MEDIO DE CULTIVO PARA Nitrobacter El medio del cultivo lleva la misma composición que el cultivo para Nitrosomonas excepto que el sulfato de amonio es reemplazado por la misma cantidad de nitrito de sodio, con el mismo tiempo de esterilización, incubación y temperatura. Para la cuantificación se le agregan tres gotas del reactivo de Griess-llosvay, si el tubo permanece incoloro esto indica la presencia de nitratos y por lo tanto el tubo será positivo para Nitrobacter.
MEDIO DE CULTIVO PARA Azotobacter
Manitol 2.0 g K2 HPO4 0.02 g Agua destilada 100 mL
Ajustar el pH de 7.3 a 7.6
Se colocan 50 mL del medio de cultivo en un matraz de 250 mL, esterilizar y una vez frío inocular con 0.1 ó 0.2 g de suelo fresco. Se incuba de 25-30 º C en la oscuridad hasta que se desarrolle una película sobre la superficie para lo cual tendrá que hacerse un observación al microscopio a partir del tercer día. Ellas son células grandes en forma de bacilos cortos y gruesos con extremos achatados (levaduriformes). Se deberán purificar en el medio antes mencionado solo que hay que agregarle 2 g de agar por cada 100 mL con el propósito de solidificar y en este medio solo crecerán organismos fijadores de nitrógeno, ya que el medio carece de él.
AGAR DE ENDO
(Coliformes) Fosfato de potasio 3.5 g Peptona 10.0 g Agar 15.0 g Lactosa 10.0 g Sulfito de sodio 2.5 g Fucsina básica 0.5 g Agua destilada 1000 mL pH final 7.4

Microbiología de Suelos 27
Este medio se utiliza para aislar coliformes y otros organismos entéricos. El sulfito de sodio y la Fucsina básica inhiben el desarrollo de bacterias Gram-positivas; las colonias fermentadoras de lactosa aparecen de color rosa o rojo, con un brillo metálicos. Se esteriliza a 15 libras de presión durante 15 minutos y se incuba a 35 º C.
MEDIO DE CULTIVO PARA BACTERIAS FITOPATOGENAS Sacarosa 10.0 g Caseína ácida hidrolizada 8.0 g Extracto de levadura 4.0 g K2 HPO4 (anhidro) 2.0 g MgSO4 .7H2 O 0.3 g Agar 15.0 g Agua destilada 1000 mL
MEDIO DE CULTIVO GENERAL Y PARA MANTENERLOS Glucosa 20.0 g Extracto de levadura 10.0 g CaCO3 20.0 g Agar 15.0 g Agua destilada 1000 mL
Los dos medios anteriores se esterilizan a 15 libras de presión durante 20 minutos y se incuba de 28-30 º C.
Figura 9 .- Cultivos de bacterias aerobias, donde se observan colonias (a), movilidad en un medio semisólido (b), y crecimiento en medio sólido en un tubo con agar inclinado (c).
a b c

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 28
X.-AISLAMIENTO DE ACTINOMICETOS Los actinomicetos se pueden considerar como un grupo de transición entre las bacterias simples y los hongos, cuyos límites se superponen con ambos. Los actinomicetos son microorganismos que producen filamentos delgados, ramificados, que se desarrollan en un "micelio" en todos los géneros del suelo, excepto el género Actinomyces, esté filamento es largo y puede fragmentarse en unidades pequeñas. Las hifas o filamentos son muy parecidas a la de los hongos, pero son muy delgados, generalmente de 0.5 a 1 milimicra de diámetro, Gram-positivos y aerobios facultativos. Muchos de estos actinomicetos producen esporas asexuales llamadas conidias, aisladas en pares o formando cadenas y solo algunos producen estructuras especializadas como los esporangios (Fig. 10). Se les encuentra en suelos ricos en materia orgánica, no toleran pH bajo, ni suelos húmedos y con baja aireación. Por regla general son saprobios, pero pueden provocar enfermedades en las plantas, animales domésticos y el hombre ( Quintero, 1984; Alexander, 1990; Van, 1997)). A pesar de estar asociados con las bacterias su relación con los hongos se manifiestan en tres propiedades: * El micelio es externo y ramificado. * Algunos actinomicetos presentan micelio aéreo. * El crecimiento en cultivo liquido rara vez produce la turbidez asociada a las bacterias, produce la formación de filamentos, grumos o esferas. El reconocimiento de los actinomicetos en placas de agar es relativamente sencillo, si se incuban un tiempo largo las colonias tienen una consistencia firme y se adhieren al sustrato, en algunos casos la superficie es pulverulenta pigmentada con esporas aéreas. Las estimaciones por cuenta en placa proporcionan valores de 105 a 108 organismos/gramo de suelo, en zonas templadas, tanto en terrenos vírgenes como terrenos cultivados y ellos constituyen del 10 al 50% de la comunidad total. En el suelo encontramos géneros como Nocardia, Rhodococcus, Streptomyces (producen antibióticos), Frankia (fija nitrógeno), Mycobacterium, Micromonospora, Thermonospora, Chainia, Agromyces y otros. El género Streptomyces es el que produce un olor a tierra mojada o a terrenos recién arados, característica que se origina por una serie de metabolitos de estreptomiceto denominados geosminas y es una sustancia formada de sesquiterpenoides, anillos de carbono insaturado, oxigeno e hidrógeno. El género Nocardia tiene semejanzas con las bacterias verdaderas ya que en su ciclo de vida presenta un micelio rudimentario que se fragmenta con facilidad en células cortas semejantes a bacilos y en medios líquidos forma turbidez.

Microbiología de Suelos 29
Figura 10 .- Grupos principales de actinomicetos (Alexander,1990) A continuación se hará mención de algunos medios de cultivo específicos para actimomicetos:
MEDIO AGAR-GLICEROL-EXTRACTO DE LEVADURA (AGEL)
Glicerol 5.0 mL Extracto de levadura 2.0 g KH2 PO4 1.0 g Agar 15.0 g Agua 1000 mL
Sol. cristal violeta 5.0 mL (acuoso al 1 %) Esterilizar a 15 libras de presión por 20 minutos, incubar a 30 º C durante 7 a 14 días, aparecen colonias brillantes húmedas o de consistencia pétrea con un contorno bien definido sobre el cual se desarrollan algunas esporas, las colonias pueden ser blancas, grises, cafés, amarillas verdosas, rojas y casi negras.
MEDIO DE CZAPEK
Agar 15.0 g NaNO3 2.0 g K2 HPO4 1.0 g MgSO4 .7H2 O 0.5 g KCl 0.5 g FeSO4 .7H2 O 0.01 g Sacarosa 30.0 g Agua destilada 1000 mL

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 30
Se disuelven las sales y se ajusta a un pH de 7.0, calentar y agregar el agar, esterilizar a 15 libras de presión durante 20 minutos, sembrar la muestra e incubar de 7 a 10 días a una temperatura de 28 º C.
MEDIO AGAR-GLUCOSA-EXTRACTO DE LEVADURA (AGE)
Glucosa 1.0 g Extracto de levadura 1.0 g Agar 2.0 g Agua destilada 100 mL
Ajustar a un pH de 6.8 Esterilizar a 15 libras por 20 minutos, prepare las placas de agar por la noche y séquelas a una temperatura de 37 º C, inocule la placa y caliente las placas de agar inoculada a 110 º C durante 10 minutos, esto inhibe el crecimiento y diseminación de colonias de bacterias y hongos. Incube las placas a 30 º C durante 5 a 7 días.

Microbiología de Suelos 31
XI.- AISLAMIENTO DE HONGOS
En suelos cultivados aireados, los hongos constituyen gran parte de la masa microbiana total; ellos son abundantes en los horizontes orgánicos de suelos boscosos o selváticos y son los que llevan a cabo la descomposición en ambientes ácidos. Los hongos filamentosos poseen un micelio con hifas independientes, pueden ser septadas o no septadas; con un diámetro consideradamente mayor que los actinomices comunes, poseen hifas vegetativas y fértiles, que producen esporas sexuales o asexuales (Herrera, 1990). En medios de cultivo el micelio es incoloro, pero las esporas asexuales están coloreadas notoriamente, su tamaño, forma de crecimiento y estructura en cultivos ayudan para conocer su ubicación taxonómica, con relativa facilidad en comparación con las bacterias. La mayoría de los hongos aislados pertenecen a la clase de los Hyphomycetes y Zygomycetese donde la clase más abundante en medios de agar es la primera, con micelios septados y el cuerpo fructífero se presenta como un conidióforo y los Zygomycetes producen esporas tanto asexuales como sexuales. La patogenicidad por hongos es una característica que se origina en el suelo, ya que algunas especies que normalmente son saprofitas pueden invadir tejido vivo y comportarse como agente patógeno. Pueden ser parásitos facultativos o parásitos verdaderos y permanecer en el suelo inactivos por períodos largos si la planta hospedera no esta o bien desaparecer por completo (Moreno, 1988; Mitchell, 1992; Edwards, 1995; Rao, 1995). Solo una pequeña parte de los hongos del suelo causan enfermedades vegetales y los que la provocan con frecuencia pertenecen a los géneros: Armillaria, Fusarium, Helminthosparium, Ophiobolus, Phytophtora, Plasmodiophora, Rhizoctonia, Sclerotium, Verticillium, Thielaviopsis, Phytium y Aspergillus. Otros son cosmopolitas y sapropios como Mucor y Penicillium, entre otros (Fig. 11).
Figura 11.- Hongos típicos en el suelo
Fusarium Aspergillus

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 32
Figura 11.- Hongos típicos en el suelo (continuación)
Existen diversas técnicas en laboratorio para su estudio. El método que se usa frecuentemente para enumerarlos, es el recuento en placa inoculada con diluciones de suelo en medio de agar selectivo, este recuento es criticado debido a que no se sabe con certeza el origen de las colonias que aparecen sobre el agar, ya que pueden ser derivadas de una espora o fragmento de micelio vegetativo, por ello el conteo de esta manera se debe interpretar con cuidado y considerar las limitaciones de está técnica. Otro método utilizado es el del portaobjetos enterrado de Rossi-Cholodny, o vaciar una mezcla de suelo y agar sobre una caja Petri. (Echegaray, 1993). Para aislar un hongo patógeno de hojas infectadas y de otros órganos de la planta, se tiene un método donde se seleccionan varios cortes pequeños de 5 a 10 mm a partir del borde de la lesión infectada, a fin de que contenga tejido enfermo y tejido al parecer sano. Esos cortes se colocan en una solución esterilizante de superficie (ver 5.3.), con lo cual la superficie se humedece y al cabo de 15 a 30 segundos los cortes se toman asépticamente uno por uno a intervalos de 15 segundos, a fin de que se esterilicen a diferentes tiempos (Agrios, 1996). Luego los cortes se secan con trozos limpios de papel estéril o se pasan por tres cambios de agua estéril y por último se colocan sobre el medio de cultivo nutritivo, de tres a cinco cortes por caja Petri. Los cortes esterilizados en su superficie durante menos tiempo generalmente
Trichoderma
Penicillium Mucor

Microbiología de Suelos 33
contienen al patógeno y a varios contaminantes, mientras que los demás tiempos no permiten el desarrollo de cualquier microorganismo, debido a la acción del esterilizante de superficie. Los cortes con tiempos intermedios permiten que sólo el patógeno se desarrolle y forme colonias puras en el cultivo, luego estás colonias se resiembran asépticamente para su cultivo (Fig. 13).
Figura 12 .- Cultivo de hongos en cajas de Petri con agar sólido
Fuente: Agrios, 1996.
Figura 13 .- Aislamiento de hongos patógenos en plantas.

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 34
El hecho de que los cuerpos fructíferos del hongo aparezcan sobre las hojas del hospedero facilita su recolección y permite durante varios segundos aplicar el esterilizante de superficie para luego ser sembrado en medio de cultivo o pueden también presionarse en una gota de agua estéril y diluir sus esporas en forma seriada con agua estéril contenida en pequeños tubos de ensayo; por último algunas gotas de cada uno de los tubos de dilución seriada se colocan en un medio nutritivo, a fin de que se desarrollen las colonias libres de contaminantes. Para aislar hongos patógenos de tallo o fruta, se puede realizar un corte de la parte infectada y por la parte donde se hizo el corte se toma una pequeña porción con una asa flameada y luego se coloca directamente en el medio de cultivo ( Mitchell, 1992). Un método que nos sirve para observar en forma intacta las estructuras de un hongo y nos facilita su determinación taxonómica es el método del Microcultivo, que se puede realizar de la manera siguiente en condiciones asépticas. 1.- Dentro de una caja Petri coloque un triángulo de tubo de vidrio y sobre de él acomode un portaobjetos y cubreobjetos estériles. 2.- Con una espátula flameada corte varios cuadros de agar solidificado y esterilizado en una caja Petri, de aproximadamente 0.5 a 1 cm, colóquelos encima del portaobjetos, que esta dentro de la caja Petri. 3.- Inocule en punto con una asa recta flameada en cada esquina del cuadro de agar y luego coloque el cubreobjetos. 4.- Vierta unos 10 mL de glicerol al 10% en el fondo de la caja Petri, para mantener húmedo el microcultivo. 5.- Incube a temperatura ambiente hasta notar crecimiento. 6.- Agregar de 3 a 4 gotas de formaldehido al microcultivo para inactivar al hongo por unos minutos. 7.- En un portaobjetos limpio coloque una gota de azul de algodón, con una pinza de disección flameada tome el cubreobjetos del microcultivo y colóquelo en el portaobjetos con el colorante . 8.- Observe al microscopio. Los hongos pigmentados no son fáciles de observar al microscopio, y se recomienda el uso de KOH al 10% o 30%, para aclarar y observar el color normal de las estructuras. También se pueden realizar preparaciones semipermanentes de hongos, para realizar con mayor facilidad su determinación y se utiliza la solución de Lactofenol de Amman, la cual tiene la siguiente composición:
SOLUCION DE LACTOFENOL DE AMMAN Fenol 20 mL Ácido láctico 20 mL Glicerol 40 mL Agua destilada 20 mL Azul de algodón 0.05 g
Todos los medios usados para cultivar hongos deben ser previamente esterilizados, los matraces no deben llenarse demasiado para evitar que al hervir se derrame el medio, por ejemplo, preparar medio litro de medio en un matraz de un litro, el cual alcanza para unas 20 cajas de Petri. A continuación se mencionar la composición de algunos medios de cultivo, los cuales se esterilizan de 15 a 20 minutos a 15 libras de presión.

Microbiología de Suelos 35
MEDIO DE ROSA DE BENGALA (MRB-2)
KH2 PO4 ...........................0.5 g K2 HPO4 ...........................0.5 g MgSO4 .7H O....................0.5 g Peptona..............................0.5 g Dextrosa..........................10.0 g Extracto de levadura..........0.5 g Rosa de bengala..............0.05 g Estreptomicina................0.03 g Agar................................17.0 g Agua destilada.............1000 mL
Este medio es preparado y esterilizado en el autoclave durante 15-20 minutos a 15 libras de presión, sin contener la estreptomicina, ya que ésta es termolábil y debe ser añadida justo antes de que el agar solidifique. Este es un medio excelente para aislar hongos del suelo y de partes de plantas. La estreptomicina retarda el crecimiento de las bacterias y el rosa de bengala disminuye el crecimiento de algunos de los hongos de rápido crecimiento. No es necesario disolver los ingredientes antes de la esterilización, a menos que se vayan a preparar tubos con agar inclinado, ya que los ingredientes se disuelven durante la esterilización.
EXTRACTO DE MALTA AGAR (EMA)
Extracto de malta........20 g Peptona.........................1 g Dextrosa......................20 g Agar.............................20 g
Agua destilada........1000 mL Los hongos que pudren la madera son a menudo cultivados en un medio con la fórmula modificada de la siguiente manera Este es otro buen medio general y se utiliza en la determinación de Penicillium y Aspergillus. Los hongos:
Extracto de malta.........25 g Agar...........................15 g Agua destilada......1000 mL
PAPA DEXTROSA AGAR (PDA)
Trozos de papas peladas.............200 g Dextrosa.......................................20 g Agar.............................................15 g Agua destilada........................1000 mL

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 36
Los trozos de papa se cosen y se hacen papilla y se filtran a través de varias capas de manta de cielo y se añade el resto de los ingredientes al filtrado. En lugar de los trozos de papa se puede usar papa para puré instantáneo, y este es un medio favorable para muchos hongos y es utilizado para cultivar hongos patógenos de plantas.
JUGO DE 8 VERDURAS AGAR (V-8 A)
Jugo V-8.. ..............180 mL Carbonato de calcio.......2 g Agar.. ..........................20 g Agua destilada......1000 mL
El medio V-8 agar es un medio excelente general de uso rutinario. La mayoría de los ascomicetos esporulan bien en él, al igual que los mucoráceos y muchos deuteromicetos. El medio es ácido (pH de 5.5) y el jugo V-8 puede sustituirse por jugo de tomate o zanahoria.
AGAR-AGUA (AA)
Agar...........................20 g agua destilada......1000 mL
El medio de agar- agua es útil cuando se requiere obtener un crecimiento micelial escaso, como cuando se intenta aislar hongos del suelo y plantas, además para inducir la esporulación de algunos hongos. Hay muchos colorantes que pueden usarse para teñir hongos como el azul de algodón y floxina (soluciones acuosas al 0.5%), agregando una o dos gotas a un lado del cubreobjetos para teñir el material fúngico.

Microbiología de Suelos 37
XII.- AISLAMIENTO DE ALGAS
Las algas están presentes casi en todos los suelos, pero no son tan numerosas como las bacterias, actinomicetos y hongos. Son muy abundantes en hábitats en los cuales la humedad es adecuada y la luz accesible, su desarrollo en la superficie de tierras vírgenes o cultivadas se nota frecuentemente a simple vista con una coloración verde sobre la superficie del mismo y es debido a que poseen clorofila. Las algas pueden ser unicelulares o pueden presentarse en pequeños filamentos, pero las cepas del suelo, como grupo, son característicamente más pequeñas y estructuralmente menos complejas que las algas acuáticas. Las algas del suelo se dividen en Chlorophytas o algas verdes, Cyanophytas o algas verde-azules, Bacillariophyta o diátomeas y Xanthophyta o algas verde-amarillas (FIG. 14).
Figura 14 .- Principales géneros de algas en los suelos
Las algas verdes son el grupo que soporta un pH ligeramente ácido, aunque son numerosas en ambientes neutros y alcalinos, las diátomeas son menos comunes en suelos ácidos, desarrollándose mejor en medios neutros y ligeramente alcalinos. Las algas verde-azules son más sensibles a los medios ácidos (menos de 5.2), y son muy frecuentes en suelos neutros y calcáreos; por último las algas verde-amarillas son muy raras en medios terrestres (Richards, 1987).
Gonium Volvox Pandorina
Nostoc Anabaena Gomphonema
Ceratium

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 38
La abundancia de las algas disminuye marcadamente en condiciones adversas y se les puede encontrar en el orden de cientos de miles o aun de millones por gramo. Su abundancia se puede determinar preparando diluciones de suelo en agua destilada, inoculando en un medio líquido o en arena esterilizada que contenga nutrimentos inorgánicos. La presencia de algas se determina microscópicamente o por examen visual de los crecimientos coloreados, después de la incubación del medio o la arena durante 4 ó 6 semanas en la luz y la cuantificación se lleva acabo por el procedimiento del número más probable; encontrando valores para suelos de cultivo de 10 000 por gramo o en otros tipos de suelo de 100 a 50 000 por gramo. La enumeración de las algas en el suelo es de valor limitado ya que es difícil interpretar la importancia de los números de unidades de algas, ya que algunas especies son filamentosas y dan cifras bajas, otras son unicelulares y cada una representa una célula y hay otras formas coloniales que producen muchas unidades viables (Alexarder, 1990). Para aislar las algas presentes en el suelo se mencionan los siguientes medios de cultivo.
MEDIO BRISTOL
NaNO3.......................0.25 g CaCl2 .......................0.025 g MgSO4 7H2O...........0.075 g K2HPO4....................0.075 g NaCl.........................0.025 g FeCl........................0.500 g
Agua destilada...............1000 mL Se prepara el medio y se coloca en tubos de cultivo y posteriormente se esteriliza a 15 libras de presión durante 20 minutos. Para inocular los tubos, se prepara una dilución de suelo 1:10 ( en solución isotónica estéril al 0.8 % de NaCl) y de ella se agrega 1 mL a los tubos de cultivo con medio Bristol con cinco repeticiones, luego se coloca donde haya luz solar a temperatura ambiente y se deja incubar por 8 semanas, para después observar las muestras al microscopio.
SOLUCION DE CHU
K2HPO4...................0.010 g MgSO47H2O............0.025 g Na2CO3 ...................0.020 g Na2SiO3 .............0.025 g Citrato Férrico..........0.003 g Agua destilada.........1000 mL
Ajustar a pH 7 Se realiza el procedimiento antes mencionado para la preparación del medio Bristol.

Microbiología de Suelos 39
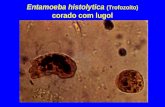
XIII.- AISLAMIENTO DE PROTOZOARIOS
Los invertebrados más abundantes en el suelo son los protozoarios, son microscópicos a diferencia de las especies acuáticas cuyo tamaño va de algunos micrómetros hasta uno o más centímetros y pueden formar quistes de cubierta gruesa en su fase de reposo (cistos). Se reproducen generalmente en forma asexual por división longitudinal o transversal (Fisión binaria). Todos los suelos tienen protozoarios, los cuales pueden ser solitarios o vivir en colonias y ser de vida libre, simbióticos o parásitos, saprofitos y fotosintéticos. Los protozoarios del suelo se clasifican en base a sus medios de locomoción y se dividen en tres grupos: a).-Mastigophora o flageladose que se mueven por medio de flagelos. b).-Sarcodina o también llamados Rhizopoda o Amiboide, los cuales poseen pseudópodos. c).-Ciliophora o Ciliados, los cuales presentan cilios durante el estado activo de su vida (Fig. 15).
Figura 15 .- Protozoarios comunes del suelo

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 40
La mayoría de los protozoarios depende de la materia orgánica preformada, alimentándose en forma saprofita, obteniendo sus nutrientes de sustancias solubles tanto inorgánica como orgánica o por una nutrición fagotrófica caracterizada por una alimentación directa de células microbianas u otras partículas, encontrándose en gran abundancia cerca de la superficie del suelo, particularmente arriba de los 15 cm (son escasos en el subsuelo), donde se encuentran en abundancia las bacterias (Edwards, 1995). Para el estudio de estos organismos se recomienda el medio líquido o de agar conteniendo extracto de suelo; estos medios son especiales para amebas y ciliados. También se pueden utilizar medios con infusiones de paja o estiércol, ricos en bacterias cortas, Gram negativas y no formadoras de esporas, como medio ideal de cultivo de los flagelados. Para la enumeración de los protozoarios se emplea la técnica de dilución estándar de suelo, en la cual se realizan varias diluciones decimales de la muestra de suelo y se inoculan porciones de ellas en medios ricos en bacterias. Debido a que los protozoarios no forman colonias diferentes, es necesario basarse en el criterio de crecimiento en placas de dilución, por lo que la presencia o ausencia del protozoario se puede determinar por examen microscópico de cada placa y el registro de positivo en cada dilución se usará para estimar el número más probable de protozoarios en la muestra original. Este método cuantifica tanto células vivas como quistes y si se quiere conocer el número de quistes, se debe agregar a la muestra de suelo 2% de ácido clorhídrico por toda la noche, este procedimiento destruye las formas vegetativas pero no a las latentes ; la diferencia en el conteo hecho antes y después de la adición del ácido, representa el número de células animales activas. Se tiene reportado que en estos medios los flagelados son generalmente más abundantes que las amebas pequeñas, mientras los ciliados son relativamente menos comunes (Alexander, 1990; Burgess, 1990). A continuación se mencionan algunos medios de cultivo de protozoarios según su medio de locomoción. INFUSION DE CHICHARO Y PAJA (Medio General) 1.- Hervir agua por 10 minutos. 2.- Vaciar 250 mL de agua hervida en otro recipiente y agregar 5 granos de chícharo y hervir otros 10 minutos. 3.- Dejar enfriar y vaciar en un frasco de boca ancha, mezclando en partes iguales la infusión de chícharo con la infusión de paja y la muestra de suelo. 4.- Se deja incubar de 6 a 8 días. Para preparar la infusión de paja se sigue el mismo procedimiento de la infusión de chícharo.

Microbiología de Suelos 41
MEDIO DE CULTIVO PARA FLAGELADOS
Peptona o Triptona...........2.00 g KH2PO4............................0.25 g MgSO4..............................0.25 g KCL...................................0.25 g FeCl...................................trazas Agua destilada................1000 mL
Esterilizar a 15 libras por 20 minutos, luego se coloca en tubos, se inocula con la muestra y se incuba de 8 a 10 días a temperatura ambiente. MEDIO PARA AMOEBA PROTEUS Y A. DUBIA 1.- Colocar una pequeña cantidad de muestra de suelo o extracto de suelo sobre una caja Petri con un poco de agua estéril. 2.- Agregar 2 o 3 granos de arroz sin coser o tallos de alfalfa hervida de 4 cm de longitud. 3.- Incubar a temperatura ambiente de 7 a 10 días. MEDIO PARA PARAMECIUM CAUDATUM Este protozoario crece en frascos cubiertos a los que se les agrega el medio Chalkley, con 7 a 12 gotas de leche sin nata, adicionada semanalmente, debe permanecer lejos de la luz en una relación de tres partes de medio y una de muestra, se debe incubar de 8 a 10 días.
MEDIO CHALKLEY
NaCL...................0.100 g Kcl........................0.004 g CaCl2.....................0.006 g Agua destilada......1000 mL
Esterilizar a 15 libras de presión por 20 minutos y seguir las indicaciones antes mencionadas.

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 42
XIV.- AISLAMIENTO DE NEMATODOS
Los nematodos tienen un aspecto vermiforme, la mayoría vive libremente en aguas dulces, saladas y en el suelo alimentándose de plantas y animales microscópicos. Se sabe que centenares de ellos viven como parásitos y se alimentan de plantas vivas, en las que producen una gran variedad de enfermedades (Edwards, 1995). Los nematodos fitopatógenos son organismos pequeños de 300 a 1000 micrómetros, con formas de anguila y en un corte transversal se ven redondos, de cuerpo liso no segmentado, sin apéndices. Sin embargo las hembras de algunas especies se hinchan en la madurez y adquieren la forma de una pera o cuerpos ovoides (Fig. 16); su cuerpo es más o menos transparente, cubierto por una cutícula incolora, la cual mudan en sus diferentes etapas larvarias. Su ciclo de vida lo llevan a cabo en 3 o 4 semanas en condiciones ambientales óptimas, con temperatura cálida. La mayoría de los nematodos fitopatógenos viven parte de su ciclo de vida en el suelo, en forma libre, alimentándose de raíces y tallos subterráneos. La temperatura, humedad y aireación del suelo afectan su sobrevivencia y se les encuentra a profundidades de 0 a 15 cm en forma común y algunas veces en profundidades mayores en torno de raíces de plantas susceptibles, con suelos muy húmedos (Christie,.1986). Los pocos nematodos que atacan a los órganos aéreos de la plantas llegan en salpicaduras cuando llueve o cuando se riega, o suben por sí mismos a las superficies húmedas de las hojas o tallos de las plantas. Estos nematodos parásitos pueden ser Ectoparásitos o Endoparásitos, pero en forma general se aislan de la raíces de las plantas que infectan o del suelo en torno a las raíces de las que se alimentan. Ambos grupos pueden ser migratorios, es decir, viven libremente en el suelo y se alimentan de las plantas sin que se fijen a ellas o se mueven dentro de la planta, también pueden ser sedentarios, es decir, las especies una vez que han penetrado en la raíz permanecen fijas a ellas (Eisenback, 1983; Richards, 1987; Werner, 1992). Los nematodos ectoparásitos incluyen a los nematodos anillos (sedentarios) y a los nematodos daga, picador y de la raíz escobilla (todos migratorios). Los nematodos Endoparásitos incluyen a los enquistados, de los cítricos y del nudo de la raíz (todos sedentarios) y a los nematodos espírale lanza inductor de lesiones, del bulbo y del tallo, perforador, foliar y del achaparramiento de las plantas (Migratorios). Los nematodos se pueden aislar de muestras frescas de suelo de 100 a 300 g, mediante los métodos del Embudo de Baermann, Tamizado y de Centrifugación o de Flotación del azúcar. La población de nematodos extraída se coloca en un recipiente con poca agua para contarlos en una alícuota conocida y así proceder a su fijación. Para su fijación, primero se relajan, para ello se aplica un calentamiento lento progresivo en la suspensión donde se encuentran hasta que e inmovilizan. Luego se transfiere al fijador que puede ser formalina al 2.5-5 % y se deja en él, de 5 a 6 días. Posteriormente se deshidrata en una mezcla de etanol, glicerina y agua destilada (20:1:79), luego se deja evaporar la mezcla y se añade de una nueva mezcla de glicerina y etanol ( 7:93 ) y por último se le agrega glicerina

Microbiología de Suelos 43
pura deshidratada. Al final los organismos se colocan en una cámara desecadora la cual contiene CaCl2, hasta su montaje. Cuando los especímenes están deshidratadas, pueden montarse de glicerina pura sobre portabjetos, cubriéndolos con un cubreobjetos y sellando los bordes con barniz de uñas transparentes (Alexander, 1990; Agrios, 1996).
Fuente: Agrios, 1996.
Figura 16 .- Forma y tamaño relativo de los nematodo más importantes
METODO DEL EMBUDO DE BAERMANN Este método consiste en la utilización de un embudo de vidrio bastante grande (de 12 a 15 cm de diámetro), el cual se encuentra unido a una goma, con una abrazadera colocada sobre el tubo. El embudo se coloca sobre un soporte y se llena con agua. La muestra de suelo se coloca en el embudo sobre un papel poroso y resistente a la humedad, sostenido por una tela de alambre o en un vaso de precipitados sobre el cual se ata un trozo de tela con una liga. El vaso

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 44
de precipitado se invierte entonces en el embudo con el trozo de tela y todo el suelo se sumerge en el agua, dejándolo así durante toda la noche o por varias horas. Los nematodos vivos se mueven activamente y migran a través de la tela o el papel poroso hacia el agua y se sumergen hasta el fondo del tubo de goma inmediatamente por arriba del nivel donde se encuentra la abrazadera. Más del 90% de los nematodos vivos se colectan en el primer volumen de agua (5 a 8 mL) acarreada desde el tubo de goma y esta muestra se coloca en una caja Petri para examinarla al microscopio o bien para aislar individualmente a los nematodos. Para aislar los nematodos de las plantas, se cortan en trozos muy pequeños y se vierten en el embudo de Baermann según el método antes descrito. METODO DEL TAMIZADO El método por tamizado se basa en el hecho de que cuando una pequeña muestra de suelo, por ejemplo: 300 g de suelo se mezclan con un volumen mucho mayor de agua ( 2 litros), los nematodos flotan en el agua, colectándose en tamices con poros pequeños. El procedimiento es el siguiente: * Se mezcla la muestra de suelo con el agua. * Se agita y se deja que repose durante 30 segundos. * El sobrenadante se cuela en un tamiz de 20 mallas (20 orificios por pulgada), el cual retiene a los residuos de gran tamaño, pero permite que los nematodos se cuelen hasta el frasco receptor. * El líquido que contiene a los organismos se vierte después a través de un tamiz de 60 mallas, el cual retiene a los de gran tamaño y algunos residuos, pero deja pasar los nematodos más pequeños y se colectan en otro recipiente. * Esté último líquido se pasa a través de un tamiz de 200 mallas, el cual retiene a los nematodos pequeños. * Ambos tamices de 60 y 200 mallas se lavan de 2 a 3 veces para remover los residuos y los organismos se colectan en cajas Petri con agua para su examen directo y posteriormente aislarlos. METODO DE CENTRIFUGACION O DE LA FLOTACION DEL AZUCAR El método de centrifugado consiste en mezclar una cantidad de suelo con agua dentro de un vaso de precipitado, agitar, luego vaciar la mezcla en tubos de centrifuga y se hacen girar a 3000 r.p.m. durante 4 minutos, posteriormente se tira el sobrenadante quedando los nematodos y residuos en el fondo del tubo, luego se llena el tubo a la mitad con una solución de azúcar (453 g/L de agua), se tapa el tubo y se agita hasta que se suspenda el sedimento, se llena el tubo con la solución de azúcar y se centrifuga a 300 rpm durante 30 a 120 segundos. Los nematodos se mantienen suspendidos en el sobrenadante, el cual se decanta en un tamiz fino quedando atrapados en él, con agua se elimina la solución azucarada que los cubre lo más rápido posible y por último los nematodos limpios se vierten en una caja Petri para efectuar una cuantificación y hacer observaciones.

Microbiología de Suelos 45
XV .- BIBLIOGRAFÍA Agrios, G.N. 1996. FitopatologÍa. Ed. Limusa. México. Alexander, M. 1990. Introductión to Soil Microbiology.Ed. John Wiley & Sons. New York. Alexopoulos, C.J. and C.W.Mims.1979. Introductory mycology. Ed. John Wiley & Sons, New York. Atlas , R. M. and Bartha, R.. 1993. Microbial Ecology. The Benjamin / Cumming Publishing Company, Inc. New York. USA. Bradshaw, J. L. 1976. Microbiología de Laboratorio. Ed. El Manual Moderno S.A. México. Brock, D.T. 1978. Biología de los Microorganismos. Segunda Edición. Ed. Omega. Barcelona, España. Brock, T. D, Smith, D. W. y Madigan, M. T. 1997. Microbiología. Ed. Prentice-Hall Hispanoamericana, S.A. México. Burges, A. 1971. Biología del Suelo. Ed. Omega. Barcelona, España. Burgess, J., Marten, M. and Taylor R. 1990. Under The Microscope. Cambridge university Press. New York, USA. Christie, J.R. 1986. Nematodos de los vegetales. Ed. Limusa. México. Costilla, M.A.1969. Nematología Agrícola. Ed. Hemisferio Sur. Chile. Cullimore, D.R. 1992. Practical Manual of Groundwater Microbiology. Lewis Publishers . Michigan , USA. Davis, Dulbecco, Fisen y Ginsberg. 1985. Tratado de Microbiología. Ed. Salvat S.A. España Delaat. A.N.C. 1985. Microbiología. Segunda Edición. Ed. Interamericana. México. Díaz, R., C. Gamazo e I. López-Goñi. 1998. Manual práctico de Microbiología. Ed. MASSON, S.A. España. Edwards, C.A., Steiner, B.R. Stinner, D. and Rabatin, S. 1995. Biological Interactions in soil. Elsevier SciencePublishiny company Inc. New York, USA. Echegaray, A. 1993. Microbiología de Suelos. Chapingo. México. Eisenback, J.D., Hirschmann, H. y Sasser, J.N. 1983. Guía para la identificación de las cuatro especies más comunes del nematodo agallador (Meloidogyne Especies).Colegio de Postgraduados, Chapingo, México.

M. en C. María de Jesús Sánchez Colín FES - Zaragoza UNAM 46
Garcia, T. A. 1991. Experimentos en Microbiología de Suelos. Ed. C.E.C.S.A. México. González, L.C. 1985. Introducción a la Fitopatología. Ed. IICA. San José, Costa Rica. Granados, P:R y Villaverde, P. M.C. 1998. Microbiología. Ed. Paraninfo. Madrid, España. Herrera, T. y Ulloa, M. 1990. El Reino de los Hongos. Ed. U.N.A.M. y Fondo de Cultura Económica. México. Jackson, R.M. 1974. La Vida en el Suelo. Ed. Omega. Barcelona, España. Johnson, T.R. and Case, CH. L: 1992. Laboratory Experiments in Microbiology. The Benjamin / Cummings Publishing Company Ind. California. USA. Koneman, Allen, Dowell y Sommers. 1997. Diagnostico Microbiológico. Ed. Medica panamericana S.A. México. Locquin, M. y Langeron, M. 1985. Manual de Microscopio. Ed. Labor. S.A. México. Mac-Faddin, J. 1984. Pruebas Bioquímicas para la Identificación de Bacterias de Importancia Clínica. Ed. Med. Panamericana. México. Madigan, M.T., J. M. Martininko y J. Parker. 1997. Biología de los microorganismos. Ed. Prentice Hall. Iberia, España. Mitchell, R. 1992. Environmental Microbiology. Ed. John Willey - Liss Inc. New York, USA. Moreno, M. E. 1988. Manual para la Identificación de Hongos en granos y sus derivados. U.N.A.M. México. Murray, J.M. 1992. Neuropathology in depth - The role of confocal microscopy. Journal of Neuropathology and Experimental Neurology. Vol 51. 475-487 pp. Piatkin, K. 1973. Microbiología. Ed. Mir. Moscu. Prescott, L. M., J.P. Harley y D. A. Klein. 1999. Microbiología. Mc. Graw-Hill- Interamericana, España. Quintero, L.R. 1984. Efectos de la labranza sobre los Microorganismos del suelo. Tesis. Chapingo. México. Ramírez-Gama, R. M., B. Luna Millán, A. M. Chávez, O. V. Madrazo, G. Tsuzuki Reyes, L. V. García, L. H. Gómez y I. Müggenburg. 2003. Manual de prácticas de Microbiología general. Facultad de Química, UNAM. México. Rao, N.S. 1995. Soil Microorganisms & Plant Growth. Scrence Publishers . New York. USA.

Microbiología de Suelos 47
Richards, B.N. 1987. The Microbiology of Terrestrial Ecosystems. Longman Scientific Technical. Jhon Wiley & Sons, Inc. New York, USA. Rickwood, D. and Hames, B.d. 1997. Bacterial Cell Culture. E d. Rose, A. H. 1977. Microbiología Química. Ed. Alhambra S.A. Madrid, España. Schlegel, H:G: 1990. General Microbiology. Ed. Cambridge Universty Press. New York. USA. Singleton, P. 1997. Bacteria in biology, biotechnology and medicina. Ed. John Wiley & Sons. New York. USA. Sprent, J.I. And Sprent, P. 1990. Nitrogen Fixing Organisms. Chapman and Hall. University Press, Cambridge. Stainer, R.Y., Ingraham, J.L. and M.L. Wheelis. 1986. The Microbial World. Ed. Prentice- Hall. New Jersey. USA. Stainer, R.Y., Ingraham, J.L. and M.L. Wheelis y P.R. Painter. 1996. Microbiología. Ed. Reverté, S.A. España. Ulloa, M. y Hanlin, H. 1978. Atlas de Micología Básica. Ed. Concepto S.A. México. Van, E.J.D., Trevors, J.T. and Wellington, H.M.E. 1997. Moderm Soil Microbiology. Marcel Dekker,Inc. New York. USA. Werner, D. 1992. Symbiosis of Plants and microbes. Ed. Chapman and Hall.. Germany.

UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
PAPIME EN216403 ISBN: 970-32-1907-1
Microbiología de suelo
Entre todas las ciencias que estudian seres vivos, la
Microbiología es, probablemente, la única que se ocupa de
todos los aspectos relativos a los organismos que
constituyen su objeto de estudio. Se trata, por tanto, de una
biología general de los microorganismos, entendiendo por
tales aquellos organismos que son invisibles al ojo humano,
sin ayuda de un instrumento óptico que amplíe su imagen, y
que son o bien unicelulares o bien pluricelulares pero con una
organización biológica muy simple. Por consiguiente, la
Microbiología se ocupa tanto del estudio de las
características inherentes a los microorganismos, tales como
su estructura celular, su bioquímica, su fisiología y su
genética, entre otras, así como sus actividades y sus
interacciones con otros seres vivos y con el medio en el que
habitan. Entre estas últimas se encuentran aquéllas
características que tienen que ver con el papel de los
microorganismos como transformadores de la materia
orgánica e inorgánica y por tanto, con la participación de los
microbios en los ciclos de los elementos en la naturaleza, así
como aquéllas que hacen que muchos de ellos se comporten
como agentes patógenos de animales y vegetales, aspectos
todos ellos de indudable interés en la agricultura.