Potenciometría
-
Upload
jefferdonado -
Category
Documents
-
view
5 -
download
0
description
Transcript of Potenciometría

LABORATORIO DE QUÍMICA ANALÍTICA
Seminario:
POTENCIOMETRÍA.
Jeferson Donado C.I.: 22 942811
CARACAS, 15 FEBRERO DE 2004.


• Los métodos potenciométricos de análisis se basan en la medida del potencial de celdas electroquímicas sin paso de corriente apreciable.
• Se ha usado en la identificación de puntos finales de valoraciones.
• Muy común en las mediciones analíticas rutinarias.

• El equipo empleado en potenciometría es sencillo y económico
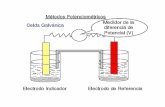
Una celda típica para el análisis potenciométrico Consta de:
Potenciómetro
e Electrodo de referencia Electrodo Indicador
Solución de analitos
Puente Salino

ELECTRODOS DE REFERENCIA
• Potencial constante y reproducible • Potencial conocido • Insensible a la composición de la solución • Resistente • Fácil de usar
Algunos de ellos, son:
ELECTRODO DE CALOMELANOS
ELECTRODO DE Ag/AgCl
ELECTRODO NORMAL DE HIDRÓGENO

ELECTRODOS INDICADORES
Respuesta rápida y reproducible a los cambios de concentración de un analito.
ELECTRODOS INDICADORES METÁLICOS Metales inertes Primera especie Segunda especie*
ELECTRODOS DE MEMBRANA Vidrio Membrana líquida Membrana cristalina Gases

E celda = Eind .- Eref .+ Eunión líquida* *Potencial generado en la unión líquida (puente salino)
Electrodo de membrana Electrodo de vidrio (pH-Metro)

Electrodos de membrana
Propiedades de las membranas
1.- Mínima Solubilidad. ( Aprox Cero)
2.- Conductividad eléctrica. (aunque sea mínima)
3.- Reactividad selectiva con el analito.
Los componentes de la matriz de la membrana deben enlazarse selectivamente con el analito

Fundamento

Potenciometría Directa Relacionar directamente el potencial de la celda observada con la concentración del analito. (ecuación de Nerst)
Algunas desventajas: •Presupone comportamiento ideal del electrodo. •Electrodo indicador de respuesta fija y constante. •Sometido a errores siempre.
Ecel. = K + (0.059/n) pX (aniones)
Ecel. = K – (0.059/n )pC (cationes)
Se describe con las ecuaciones

Calibrado estandar: Consiste en observar la respuesta del electrodo a diferentes concentraciones estándar del analito y construir la curva de calibrado.
Adiciones estándar: Consiste en adicionar concentraciones estándar crecientes de analito a la muestra desconocida y representar la curva. La intercesión por extrapolación con el eje de abscisas proporciona la concentración de la muestra desconocida.
Aplicaciones

Potenciometría Indirecta
Titulaciones Potenciométricas
Medir potencial de un electrodo indicador apropiado en función del volumen de titulante
Aportan datos mas fiables que en las titulaciones volumétricas (indicadores químicos)
Poseen ventajas adicionales sobre la potenciometría directa.

Potenciometría Indirecta
El punto de equivalencia se determina gráficamente representando pH vs. Volumen de titulante gastado
pH en función de V Primera derivada Segunda derivada

• Determinar el contenido de ácido acético en una muestra de vinagre comercial empleando valoraciones potenciométricas.
GENERAL
•Apreciar la variación de pH del analito ante la adición de solución de NaOH.
•Construir la gráficas de pH Vs. Vtitulante, para observar el salto indicador de la llegada hasta el punto de equivalencia.
•Efectuar un barrido de volumen de titulante añadido a la solución problema para apreciar el rango de cambio y observar en forma clara el punto final de las titulaciones.
•Determinar gráficamente el punto final de las titulaciones.
•A partir del punto final de las tres titulaciones, calcular el volumen promedio de NaOH.
•A partir del volumen promedio de NaOH y el factor de dilución, calcular el porcentaje de acidez del vinagre.
ESPECÍFICOS

1. Pesar aproximadamente 30,00 g de una muestra de un vinagre comercial en un beaker de 100 mL.
A- PREPARACIÓN DE LA MUESTRA
2. Verter la masa de vinagre en un balón aforado de 500 mL, y diluir hasta la marca del aforo.

B- MONTAJE DEL EQUIPO.
3. Lavar una bureta de 50 mL y curarla con una solución de NaOH (Concentración conocida)
4. Encender el pH-metro y calibrarlo con dos soluciones buffers (amortiguadoras) de pH 4 y 7 respectivamente. Lavar el electrodo de vidrio con agua destilada antes de cada calibración y colocarlo en una solución neutra luego de cada calibración.
5. Colocar la bureta ya curada sobre un soporte universal y enrasarla con la solución de NaOH. Se verterá sobre un beaker ubicado un una plancha se agitación

C- TITULACIÓN POTENCIOMÉTRICA.
6. Tomar una alícuota de 25 mL del vinagre contenido en el balón de 500 mL y verterlo en un beaker de 100 mL.
7. Colocar el beaker sobre la plancha de agitación, introdcirle un agitador magnético y sumergir los electrodos del pH-metro en la solución.
8. Encender la plancha de agitación y evitar el contacto entre el bulbo, el agitador magnético y las paredes del beaker.
9. Esperar hasta alcanzar el equilibrio y anotar el valor inicial del pH de la solución.
(Vtitulante = 0)
10. Añadir la solución de NaOH colocada en la bureta de mL en mL a la solución del beaker. Anotar para cada volumen de NaOH añadido, el pH de la solución resultante al alcanzarse el equilibrio.
11. Añadir la solución de NaOH, hasta que la lectura del pH tienda a permanecer constante luego de un salto brusco en el valor del pH. Anote para cada mL añadido el valor del pH y el volumen de NaOH utilizado hasta ese momento.

16. Repetir los pasos 13, 14 y 15 dos veces. Apagar el equipo, recoger todo el material utilizado y limpiarlo.
12. Detener la agitación y desecha la solución del beaker.
13. Añadir una nueva alícuota de
25 mL de la solución de vinagre a un beaker limpio.
14. Repetir los pasos 7 y 8.
15. Encender la plancha de agitación y añadir el volumen de NaOH necesario para llegar aproximadamente a 1 mL antes del salto brusco en el valor del pH y comience a agregar la solución de NaOH de 0,10 mL en 0,10 mL hasta completar un barrido de 2,00 mL y anote para cada volumen de NaOH, el valor del pH y deseche la solución resultante.