Tema 3. la diversidad de la materia
-
Upload
abraham-torres-calero -
Category
Documents
-
view
292 -
download
0
Transcript of Tema 3. la diversidad de la materia
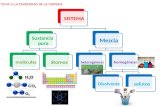
1. Clasificación de los sistemas materiales
2. Separación de mezclas heterogéneas
3. Las disoluciones
4. Sustancias puras: elementos y compuestos
1. Clasificación de los sistemas materiales Las sustancias puras tiene una composición y una
sustancias estables, independientemente de las condiciones físicas que les rodean. Una sustancia pura puede estar constituida por elementos o por compuestos. Los elementos son sustancias integradas por un solo tipo de átomo, mientras que los compuestos contienen dos o mas tipos de átomos distintos unidos entre sí.
Las mezclas están formadas por dos o más sustancias puras, que podrán verse, o no, a simple vista.
1. Clasificación de los sistemas materiales Los elementos están constituidos por el mismo tipo
de átomos, estén aislados o unidos entre sí.
Los compuestos están formados por el mismo tipo de partículas, aunque pueden dividirse en otras particulas más simples.
Las mezclas están formadas por distintos tipos de sustancias puras.
1. Clasificación de los sistemas materiales Mezclas heterogéneas: las propiedades y la
composición varían de un punto a otro dentro de la mezcla, por lo que podemos diferenciar visualmente las partes que la constituyen.
Mezclas homogéneas: las propiedades y la composición son fijas en todos los puntos de la mezcla. En este tipo no se diferencian visualmente las partes que componen la mezcla. También se conocen como disoluciones.
3. Las disoluciones Una disolución es una mezcla homogénea cuyos
componentes no pueden diferenciarse a simple vista y se encuentran en proporción variable. En toda disolución debemos diferenciar:
Soluto: es el componente que se encuentra habitualmente en menor proporción. Es la sustancia que se disuelve.
Disolvente: es el componente que se encuentra en mayor proporción o que mantiene su estado de agregación. El disolvente es la sustancia que disuelve al soluto.
3. Las disoluciones Estado de la disolución
Disolvente Soluto Ejemplo
Sólido Sólido
Sólido Aleaciones
Líquido Arcilla húmeda
Gas Hidrogeno en paladio
Líquido Líquido
Sólido Azúcar en agua
Líquido Alcohol en agua
Gas Oxígeno en agua
Gas Gas
Sólido Humo
Líquido Aerosoles
Gas Aire
3. Las disoluciones
La concentración de una disolución expresa numéricamente la cantidad de soluto que hay en una disolución.
𝑪𝒐𝒏𝒄𝒆𝒏𝒕𝒓𝒂𝒄𝒊ó𝒏 = 𝒄𝒂𝒏𝒕𝒊𝒅𝒂𝒅 𝒅𝒆 𝒔𝒐𝒍𝒖𝒕𝒐
𝒄𝒂𝒏𝒕𝒊𝒅𝒂𝒅 𝒅𝒆 𝒅𝒊𝒔𝒐𝒍𝒖𝒄𝒊ó𝒏
3. Las disoluciones Porcentaje en masa : % 𝒆𝒏 𝒎𝒂𝒔𝒂 =
𝒎𝒂𝒔𝒂 𝒅𝒆 𝒔𝒐𝒍𝒖𝒕𝒐
𝒎𝒂𝒔𝒂 𝒅𝒆 𝒅𝒊𝒔𝒐𝒍𝒖𝒄𝒊ó𝒏 ∙ 𝟏𝟎𝟎
Porcentaje en volumen: % 𝒆𝒏 𝒗𝒐𝒍𝒖𝒎𝒆𝒏 = 𝒎𝒂𝒔𝒂 𝒅𝒆 𝒔𝒐𝒍𝒖𝒕𝒐
𝒗𝒐𝒍𝒖𝒎𝒆𝒏 𝒅𝒆 𝒅𝒊𝒔𝒐𝒍𝒖𝒄𝒊ó𝒏 ∙ 𝟏𝟎𝟎
Concentración en masa: 𝑪𝒐𝒏𝒄𝒆𝒏𝒕𝒓𝒂𝒄𝒊ó𝒏 𝒆𝒏 𝒎𝒂𝒔𝒂 = 𝒎𝒂𝒔𝒂 𝒅𝒆 𝒔𝒐𝒍𝒖𝒕𝒐
𝒗𝒐𝒍𝒖𝒎𝒆𝒏 𝒅𝒆 𝒅𝒊𝒔𝒐𝒍𝒖𝒄𝒊ó𝒏
3. Las disoluciones La solubilidad de un soluto en un disolvente es la
cantidad máxima que puede disolverse de este soluto en 100 g del disolvente, a una temperatura determinada.
𝑺𝒐𝒍𝒖𝒃𝒊𝒍𝒊𝒅𝒂𝒅 = 𝒈 𝒅𝒆 𝒔𝒐𝒍𝒖𝒕𝒐
𝟏𝟎𝟎 𝒈 𝒅𝒆 𝒅𝒊𝒔𝒐𝒍𝒗𝒆𝒏𝒕𝒆
3. Las disoluciones Evaporación: se calienta la disolución hasta alcanzar
el punto de ebullición de líquido y se espera a que todo el líquido se haya evaporado. El sólido queda en el fondo del recipiente.
Cristalización: se deja el recipiente abierto para que el líquido se vaya vaporizado poco a poco.
3. Las disoluciones Separación de mezclas
Heterogéneas
Filtración
Criba
Sedimentación
Decantación
Centrifugación
Separación magnética
Homogéneas
Evaporación
Cristalización
Destilación
Disolución selectiva
Destilación de gases
Cromatografía