ESCLEROSIS MÚLTI LE - revistaesclerosis.esrevistaesclerosis.es/pdf/Esc_35.pdf · 1Servicios de...
-
Upload
vuongtuong -
Category
Documents
-
view
221 -
download
0
Transcript of ESCLEROSIS MÚLTI LE - revistaesclerosis.esrevistaesclerosis.es/pdf/Esc_35.pdf · 1Servicios de...

Editorial: Las aportaciones de natalizumabÓscar FernándezDirector de Revista Española de Esclerosis Múltiple
Aspectos patofisiológicos de la esclerosis múltipleTeresa Tuñón1, Teresa Ayuso2
1Servicios de Anatomía Patológica y 2Neurología del Complejo Hospitalario de Navarra. Banco de tejidos neurológicos. Navarra Biomed.
Natalizumab en intervalo expandido de dosis en pacientes con esclerosis múltiple José Vicente Hervás García1, Laia Grau López2, Ane Miren Crespo Cuevas2, Cristina Ramo Tello1
1Unidad de Esclerosis Múltiple, Servicio de Neurología. Departamento de Neurociencias. 2Servicio de Neurología. Departamento de Neurociencias. Hospital Germans Trias i Pujol. Badalona (Barcelona).
Bases para un algoritmo terapéutico en esclerosis múltipleLuis Brieva RuizJefe Sección de Neurología. Hospital Universitario Arnau de Vilanova.Lleida.
Novedades bibliográficasAna Mª Alonso TorresHospital Regional Universitario de Málaga.
Volu
men
VII
- N
º 35 -
Sep
tiem
bre
de
2015
ESCLEROSIS MÚLTI LE
REVISTA ESPAÑOLA DE
EDITA:


MÚLTI LE S T A F F
REVISTA ESPAÑOLA DE
Director:Óscar Fernández Fernández
Director de la UGC Neurociencias Jefe de Servicio de Neurología
Hospitales Universitarios Regional de Málaga y Virgen de la Victoria
A. Alonso TorresR. Bustamante ToledoV. Fernández SánchezM. Guerrero Fernández
A. León Martín
L. Leyva FernándezG. Luque Fernández J. A. Tamayo Toledo F. Romero Crespo
A. L. Muñoz Becerra
Jose Carlos Álvarez CermeñoTxomin Arbizu UrdainRafael Arroyo GonzálezMarina BujandaFrancisco Coret FerrerJ. A. García-MerinoMiguel Ángel Hernández PérezCarlos Hernández LahozGuillermo Izquierdo Ayuso
Yolanda Aladro BenitoCarmen Arnal GarcíaJose Ramón Ara CallizoJoaquín Argente AlcaláManuel Arias GómezJulián BenitoWadih Bowakin DibLuís Brieva RuízInma Bonaventura IbarsCarmen Durán HerreraJoaquín Escudero TorrellaRicardo Fernández BolañosDionisio Fernández UríaJesús Foronda BenogaPedro García Ruíz-EspigaJuan Carlos García-MancoMaría Pilar Granés IbáñezPedro Guardado Santerías
MadridBarcelonaMadridNavarraValenciaMadridSta. Cruz de TenerifeOviedoSevilla
Xavier Montalbán GairinFco. Javier Olascoaga UrtazaJose María Prieto GonzálezAlfredo Rodríguez AntigüedadAlbert Saiz HinarejosAlberto Tuñón ÁlvarezClara de Andrés de FrutosPurificación de Castro LorenzoJordi Matías-Guiu Guía
BarcelonaSan SebastiánSantiago de CompostelaBasurto (Vizcaya)BarcelonaOviedoMadridPamplonaMadrid
Comité asesor:
Comité de redacción:Secretaria de redacción: Celia Oreja Guevara
Getafe (Madrid)GranadaZaragozaCádizS. de CompostelaMóstoles (Madrid)ValladolidLleidaTarrasa (Barcelona)BadajozValenciaSevillaAsturiasJaénMadridBilbaoLéridaAlmería
Miguel Guerrero FernándezJose Mª Gutiérrez GarcíaCristina Íñiguez MartínezFrancisco LacruzJosé Meca LallanaCelia Oreja GuevaraÁngel Pérez SempereCristina Ramo Tello Jordi Río IzquierdoElena Rodríguez GarcíaJesús Romero LópezJaume Roquer GonzálezFernando Sánchez LópezMar Tintoré SubiranaAntonio UclésAntonio Yusta IzquierdoJuan José ZarranzImirizaldu
GranadaValladolidZaragozaNavarraMurciaMadridAlicanteBadalonaBarcelonaMadridVigoBarcelonaCórdobaBarcelonaSevillaGuadalajara
Bilbao
Comité científico:
C/ Concha Espina, 8 - 1º Dcha. 28036 Madrid Teléfono: 91 411 00 32Fax: 91 411 01 46E-mail: [email protected]
Depósito Legal: M-24807-2006 ISSN: 1885-7590
© 2015
EDITA:
ESCLEROSIS

13
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
Sumario
Editorial: Las aportaciones de natalizumabÓscar FernándezDirector de Revista Española de Esclerosis Múltiple 5
Aspectos patofisiológicos de la esclerosis múltipleTeresa Tuñón1, Teresa Ayuso2
1Servicios de Anatomía Patológica y 2Neurología del Complejo Hospitalario de Navarra. Banco de tejidos neurológicos. Navarra Biomed. 6
Natalizumab en intervalo expandido de dosis en pacientes con esclerosis múltiple José Vicente Hervás García1, Laia Grau López2, Ane Miren Crespo Cuevas2, Cristina Ramo Tello1
1Unidad de Esclerosis Múltiple, Servicio de Neurología. Departamento de Neurociencias. 2Servicio de Neurología. Departamento de Neurociencias. Hospital Germans Trias i Pujol. Badalona (Barcelona). 14
Bases para un algoritmo terapéutico en esclerosis múltipleLuis Brieva RuizJefe Sección de Neurología. Hospital Universitario Arnau de Vilanova.Lleida. 18
Novedades bibliográficasAna Mª Alonso TorresHospital Regional Universitario de Málaga. 33 Agenda de congresos 37
REVISTA ESPAÑOLA DE
ESCLEROSIS M Ú L T I L EVolumen VII - Nº 35 - Septiembre de 2015
4

5
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
El natalizumab ha constituido un avance muy importante en el trata-miento de la esclerosis múltiple por varios motivos. En primer lu-
gar, ha sido la prueba de que interviniendo en un punto muy específico de la cadena patogénica se puede mejorar la historia natural de la esclerosis múltiple, de forma muy considerable. El segundo aspecto es que también es la demostración de que las intervenciones sobre el sistema inmune pueden resultar en complicaciones, a veces inesperadas y graves, a medio o largo plazo.
En este número de la revista se publica por los autores José Vicente Hervás García, Laia Grau López, Ane Miren Crespo Cuevas y Cristina Ramo Tello un artículo muy interesante referido a la “utilización de inter-valo expandido de dosis de natalizumab (cada 6 semanas) respecto a va-riables clínicas, radiológicas, serológicas y económicas”. Esta estrategia se utilizaría, esencialmente, para intentar disminuir el riesgo de Leucoen-cefalopatía Multifocal Progresiva (LMP).
Se trata de un artículo muy interesante en muchos aspectos, es un estudio descriptivo, unicéntrico y prospectivo de 3 años de evolución (mayo 2012-mayo 2015). Se incluyeron 16 pacientes con EMRR en trata-miento con natalizumab cada 4 semanas (según ficha técnica) durante al menos 13 meses que aceptaron el cambio a natalizumab cada 6 semanas.
Los autores refieren que los pacientes continuaron sin actividad clí-nica ni radiológica, pero comunican un caso de LMP en su casuística de pacientes tratados con la dosis cada 6 semanas, con lo que el principal objetivo no se consigue.
En este estudio se plantean problemas interesantes tales como ¿cuál es la dosis más adecuada de natalizumab?, ¿cuál es el intervalo más ade-cuado entre dosis?, ¿cómo repercutirían las modificaciones de dosis o fre-cuencia de administración en la actividad clínica y radiológica?, ¿es posi-ble reducir el coste por paciente tratado? y, finalmente, ¿se puede reducir la incidencia de LMP con estas estrategias?
El artículo mencionado supone una aproximación muy interesante y, aunque no responde por completo a estas preguntas, plantea las pregun-tas adecuadas, que deberán ser contestadas definitivamente con estudios multicéntricos, que incluyan a más pacientes y con plazos más largos de seguimiento.
Óscar Fernández
Director de Revista Española de Esclerosis Múltiple
Las aportaciones de natalizumab
Editorial

13
6
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSiónrEviSión
Aspectos patofisiológicos de la esclerosis múltipleTeresa Tuñón1, Teresa ayuso2
1Servicios de Anatomía Patológica y 2Neurología del Complejo Hospitalario de Navarra. Banco de tejidos neurológicos. Navarra Biomed.
RESUMEN. La esclerosis múltiple (EM) es una enfermedad inflamatoria crónica y degenerativa del Sistema Nervioso Central (SNC). La neuropatología aporta amplia información sobre los complejos mecanismos fisiopatológicos que originan la discapacidad progresiva de los pacientes con EM, la estrecha relación entre inflamación y neurodegeneración y la patogénesis de otras enfermedades desmielinizan-tes de SNC.Palabras clave: esclerosis múltiple, placas desmielinizantes, daño axonal, desmielinización cortical, sustancia blanca aparentemente normal, remielinización, esclerosis concéntrica de Baló, lesiones tumefactivas.
ABSTRACT. Multiple sclerosis (MS) is a chronic inflammatory and degenerative disease of the Central Nervous System (CNS). Neu-ropathological studies have provided wide information regarding the complex physiopathological mechanisms that cause irreversible progressive disability in MS, the relationship between inflammation and neurodegeneration and the pathogenesis of other demyelinating disorders.Key words: multiple sclerosis, focal lesions, axonal injury, cortical demyelination, normal-appearing white matter, remyelination, Balo’s concentric sclerosis, tumefactive lesions.
a esclerosis múltiple (EM) es una enfermedad infla-matoria desmielinizante crónica que se acompaña de degeneración progresiva neuroaxonal. Está media-da por linfocitos T citotóxicos, que se dirigen con-tra ciertos componentes de la mielina del SNC. La inmunidad humoral también juega un papel impor-tante en el mecanismo inflamatorio apoyado por la presencia de bandas oligoclonales en líquido cefalo-rraquídeo y folículos linfoides en placas corticales subpiales1. Además, en LCR, se identifican neurofi-lamentos de cadena pesada, indicativos de daño axo-nal2-4 .
El mecanismo es muy complejo y participan múltiples componentes del tejido nervioso: mielina, axón, glía, mitocondrias, microambiente intersticial, etc. La evolución, benigna a veces y gravemente dis-capacitante en otros, tampoco es consecuencia de un único mecanismo.
❑ Estudio histopatológico en esclerosis múltiple
La metodología para el estudio de la EM requiere la utilización de ciertas técnicas de histoquímica e inmunohistoquímica que son asequibles y reprodu-cibles en la mayoría de los servicios de Anatomía Patológica: Hematoxilina-Eosina, Pas, Pas-Diasta-sa, Luxol-Fast-blue o Kluver-Barrera, para la mie-lina, Bodian o Bielchowsky, técnica de Túnel para
la apoptosis, Bcl-2, anticuerpos frente antígenos de subpoblaciones linfocitarias CD5, CD3, CD4, CD8, CD20, macrófagos CD68, CD163, HLA D, plasmá-ticas CD138, proteína acídica glial, proteína básica de mielina PBM y anti-MOG. Los axones expre-san anticuerpos frente a neurofilamento fosforilado (SMI32, RT97 y BF10) y frente a la proteína precur-sora del amiloide, APP. En el diagnóstico diferencial con otras lesiones desmielinizantes conviene utilizar también marcadores contra diferentes virus oligoden-drotropos1.
Podemos utilizar además la inmunohistoquímica o la inmunofluorescencia directa en tejido congelado frente a diferentes inmunoglobulinas y complemen-to que se han puesto de manifiesto en algunas placas cuyo mecanismo etiopatogénico está mediado prefe-rentemente por células B.
A nivel macroscópico el cerebro puede ser nor-mal, atrófico o ligeramente aumentado de volumen. La atrofia se debe a varios factores, pérdida de pa-rénquima, mielina, axones y posiblemente también de astrocitos. En las fases más activas el cerebro está aumentado de volumen, debido a la abundancia de macrófagos, células inflamatorias y los fluidos inters-ticiales que se forman.
La afectación se produce a todos los niveles del SNC. En los cortes coronales o axiales se identifi-can las placas desmielinizadas que caracterizan a la enfermedad. Dichas placas, macroscópicamente pre-
L
Corre
spon
denc
ia: T
eres
a Ayu
so B
lanco
– S
ervic
io d
e Neu
rolo
gía –
Com
plejo
Hos
pita
lario
de N
avar
ra
C/ Ir
unlar
rea,
3 –
3100
8 Pa
mplo
na (N
avar
ra) –
Telé
fono
: 848
422
222
– E
: tay
usob
l@cfn
avar
ra.es

7
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
sentan tras la fijación del cerebro un tono gris o rosa-do, bordes bien definidos, contornos redondos u ova-les, tendencia a confluir entre sí y el tamaño oscila entre pocos milímetros y 1,5 centímetros. Las formas tumefactivas son de mayor tamaño y consistencia disminuida sin edema periférico.
Las principales localizaciones de las placas son: sustancia blanca periventricular, más frecuen-te a nivel posterior, unión córtico-medular, corteza cerebral, nervio y quiasma óptico. En el tronco del encéfalo, se afecta sobre todo el suelo del cuarto ventrículo, región periacueductal, núcleo de la oli-va inferior, núcleo del V y del VIII par craneal. En el cerebelo, las placas se distribuyen en la sustancia blanca de las folias, los pedúnculos cerebelosos y alrededor del cuarto ventrículo. La afectación de la médula espinal es muy común, es asimétrica y puede localizarse alrededor del epéndimo, en ambas caras de la cisura anterior, en los cordones laterales y en los dorsales.
❑ Tipos de placas de esclerosis múltiple
Según patrón histológico y tiempo de evoluciónLa heterogeneidad epidemiológica, clínica y
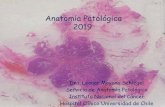
etiológica de esta enfermedad es bien conocida y aceptada. Del mismo modo hay una marcada varie-dad morfológica entre unas placas y otras. De inicio, las placas se clasificaron según su patrón histológico en activas, lentamente expansivas, inactivas y placas en sombra o remielinizadas5-7. En las placas activas, el sustrato morfológico es muy inflamatorio y la ar-quitectura muy compleja. En los momentos iniciales cuando la mielina todavía está intacta, se demuestra apoptosis de oligodendrocito mediante técnica de tú-nel y activación precoz de la microglía con expresión inmunohistoquímica de CD68+ CD163. Cuando la mielina se rompe hay una primera fase sin fagocito-sis ni células inflamatorias, que recibe el nombre de “estadio prefagocítico”. Seguidamente se produce un importante infiltrado de macrófagos y linfocitos. Es el “estadio fagocítico”. El cuadro se localiza ini-cialmente en los espacios perivenulares formando manguitos de linfocitos T, CD4 y CD8+ sobretodo, algunos B, CD20+, y macrófagos en cantidad varia-ble. Al inicio, la inflamación y los macrófagos pue-den verse en la zona más central, placa aguda activa, para posteriormente situarse en zonas más periféri-cas, placa crónica activa (Figura 1). Las placas len-tamente expansivas, muestran un área central cica-tricial e inerte, rodeada de un anillo de linfocitos y microglía activada que fagocita restos de mielina y axones rotos. Es interesante la información que nos ofrecen estas placas. La lesión inicial se ubica alre-dedor del vaso y va progresando de manera expansi-
va. En función de la intensidad del brote, los círculos expansivos adquieren mayor relevancia. Las placas inactivas son las que suelen observarse en los cere-bros de las autopsias de pacientes con enfermedad muy evolucionada. Histológicamente son placas muy definidas, cicatriciales sin mielina, ni inflamación, ni remielinización, con mayor número de axones rotos y escasos macrófagos. La imagen morfológica es la de una cicatriz de gliosis fibrilar astrocitaria. Placas en sombra o sombreadas: indican remielinización es-table y son más comunes en pacientes por encima de los 50 años con EM de larga evolución8, 9.
Según mecanismo etiopatogénicoEn las placas activas, caracterizadas radiológica-
mente en resonancia por captación de gadolinio, se observó que el contorno y los bordes de las placas
Placa crónica activa. 1a.- Hematoxilina Eosi-na (H&E), infiltrado denso de microglía y macrófagos peri-vasculares e intersticiales sobre tejido nervioso con gliosis gemistocítica. 1b.- Tinción IHQ CD163 para macrófagos y microglía perivascular e intersticial. 1c.- Tinción Luxol Fast Blue (LFB) para mielina. Palidez indicativa de desmieliniza-ción. 1d.- Tinción IHQ anti-APP. Que pone de manifiesto importante daño axonal. 1e.- Tinción IHQ para CD3 que demuestra linfocitos T perivenulares e intersticiales. 1f.- Tinción IHQ anti CD20, ocasionales linfocitos B.
Figura 1
a
c
e f
d
b
Teresa Tuñón, Teresa ayuso

13
8
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSión
podían variar, y esto hacía sospechar diferentes me-canismos de formación en los pacientes en general. Estudiando 50 biopsias correlativas se postuló la idea que las placas de cada paciente tenían todas un mecanismo etiopatogénico común y se clasificaron en cuatro tipos5, 6, 9, 10. Las tipo I están formadas úni-camente por abundantes macrófagos y linfocitos T, lo cual indica un mecanismo de formación mediado por inmunidad celular; las de tipo II caracterizadas por depósito de Inmunoglobulinas y complemen-to, intervienen mecanismos de inmunidad humoral e hipotéticamente responderían a la plasmaféresis. En las de tipo III, la lesión es similar a los cambios hipóxicos inducidos por daño mitocondrial con pro-ducción de radicales libres ROS e iNOS. Este tipo de lesiones se acompaña de hipoxia histotóxica y po-drían responder al tratamiento con antioxidantes. Por último están las placas tipo IV que se caracterizan por lesiones oligodendrogliales activas en la zona periférica de la placa.
Esta clasificación etiopatogénica justificaría la realización de biopsias en las fases activas para tra-tar de forma individualizada a los pacientes. Pero la demostración de diferentes patrones de daño tisular en un mismo paciente, asociada al bajo rendimien-to diagnóstico es una prueba muy agresiva, la hacen desaconsejable en la actualidad8, 10.
❑ Inflamación, desmielinización y neurodegeneración
La EM se ha considerado durante años el paradigma de las enfermedades desmielinizantes, es decir aque-llas en las que la mielina una vez formada se destru-ye. La afectación del axón era tardía y se consideraba secundaria11. El diagnóstico diferencial se planteaba sobre todo con las enfermedades dismielinizantes, leucodistrofias, que son aquellas en las que la mielina no llega a adquirir nunca un estado de madurez com-pleto. Incluso, los textos de Neuropatología descri-bían la preservación axonal como criterio diagnóstico morfológico. En los últimos años con un mayor co-nocimiento patogénico, se demostró que la afectación es más extensa y compromete también a la sustancia gris. El fenómeno inflamatorio y la desmielinización son el sustrato patológico de las recaídas pero se ha comprobado que neuronas y axones se afectan y lo hacen desde fases precoces contribuyendo a cronifi-car la enfermedad y siendo la causa más importante de la discapacidad neurológica a largo plazo12, 13.
La relación entre inflamación y neurodegenera-ción es compleja y en ocasiones se han considerado fenómenos independientes, sin embargo múltiples estudios patológicos demuestran que están interre-lacionadas1. Parece claro que en fases iniciales de la
enfermedad la degeneración depende estrechamente del fenómeno inflamatorio y las terapias antiinflama-torias que controlen la enfermedad ayudan a prevenir el deterioro clínico de los pacientes actuando indi-rectamente como terapias neuroprotectoras. En fases avanzadas de la EM, la inflamación disminuye y la barrera hematoencefálica está cerrada a pesar de que el proceso degenerativa progresa; esto significa que la inflamación está atrapada dentro del compartimen-to cerebral.
En la médula espinal hay menos inflamación que en las lesiones parenquimatosas cerebrales y escasa relación entre desmielinización y daño axonal. Los segmentos medulares cervicales son los más afecta-dos14, 15.
Por otra parte, estudios neuropatológicos sobre todo en las formas progresivas revelaron en la sus-tancia blanca aparentemente normal (SBAN) un daño axonal global que no está en relación con las placas desmielinizadas16, 17.
❑ Sustancia blanca aparentemente normal
Además de las placas desmielinizadas y del fenó-meno neurodegenerativo que sucede en ellas, en la EM se ha visto que la SBAN tiene una afectación difusa que se pone de manifiesto de forma muy evi-dente con técnicas de neurorradiología y también en los estudios anatomopatológicos16, 18. Se denomina SBAN aquella que dista al menos 1 centímetro de una placa1. Se han demostrado lesiones sutiles en T2 y mediante espectroscopía con RM una reduc-ción de N-acetyl aspartato (NAA). Este aminoácido es un indicador de integridad neuronal y cuando se encuentra reducido en RM es indicativo de daño neu-ronal19, 20. La afectación tanto en RM como el estudio microscópico, sugiere degeneración walleriana con interrupción del flujo axonal. Además, los axones es-tán más delgados, lo que los hace más vulnerables. Esta lesión se pone de manifiesto mediante técnicas inmunohistoquímicas para axones, SMI32 o APP (Fi-gura 2). En algunos pacientes se han observado ye-mas sinápticas que indican un intento de reposición de los axones seccionados. La microglía en la sus-tancia blanca también se activa y aumenta el número de células CD68 que expresan HLA de clase II, y la sintasa del ácido nítrico inducible, iNOS, se dispersa globalmente por toda la SBAN. También se determi-nan otros restos fagocíticos, relacionados o no con la hipoxia, con los radicales libres y con el daño mi-tocondrial, aunque en cantidad mucho más reducida que en las placas. En la SBAN el daño axonal y la inflamación no se relaciona con la desmielinización ni con el número, actividad y tamaño de las zonas de sustancia blanca destruida9.

9
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
❑ Lesiones corticales e infiltrados en las meninges
Las placas corticales en las formas agudas y remiten-tes de la EM son infrecuentes y de pequeño tamaño. Por el contrario en las formas primaria y secunda-riamente progresivas, EMPP y EMSP, son muy ha-bituales llegando afectar hasta al 60% de la corteza tanto cerebral como cerebelosa10. El hipocampo y cerebelo son sitios comunes de afectación. Se han identificado tres tipos de lesiones: corticales, cortico-subcorticales, e intracorticales. Son placas pequeñas, centradas por vasos rodeados de células inflamatorias y hay desmielinización subpial. Hay numerosos ma-crófagos CD68+ que expresan HLA D. Esta última es la más frecuente en el estadio progresivo de la enfermedad. En la patología cortical se demostraron también axones fragmentados e incluso neuronas en apoptosis, con la consiguiente reducción en el núme-ro de neuronas. La relevancia clínica de las placas es alta siendo consideradas como un sustrato patológico adiccional del deterioro cognitivo de pacientes con EM21-24 .
Especialmente interesante es lo que ocurre en las meninges y la zona subpial de la corteza25-27. El infiltrado inflamatorio cuando comienzan a formar-se las placas y también cuando las placas crónicas se hacen activas, es predominantemente a expensas de células T en forma de manguitos perivenulares. Pero en observaciones de autopsias, las meninges mues-tran acúmulos de linfocitos B y el subtipo linfocitario que aparece es de linfocitos B que expresan CD20 e incluso folículos (Figura 3). Cuando se limpia el pa-rénquima, linfocitos B y T y células plasmáticas de vida más larga se localizan en las meninges, introdu-ciéndose en la corteza muy focalmente. Se postula que tanto los linfocitos B como las células plasmáti-cas, producen alguna sustancia soluble que se intro-duce en el intersticio del tejido cerebral que tendría un papel crucial en la participación de algunas neuro-nas corticales. El infiltrado B es el responsable de la presencia de bandas oligoclonales en el LCR. Dichas bandas persisten después del brote.
❑ Vías moleculares de la neurodegeneración
Está ya asumido que en la EM hay neurodegenera-ción progresiva de las neuronas, tanto del soma, como del axón11, 1, 3, 4. Estudios recientes han sugeri-do que la participación axonal es independiente de la desmielinización, para algunos autores es en el axón donde comienza la cascada de eventos que suceden a la inflamación, y por tanto, el responsable de la neurodegeneración4, 2. Sin embargo parece claro que
Figura 3 Lesión meníngea y corteza. 3a.- H&E: infiltrado inflamatorio meníngeo de linfocitos y plasmáticas . 3b y 3d.- Tinción IHQ anti CD3 CD20+ con aislada representación de linfocitos. 3c.- Tinción IHQ CD163: macrófagos en menin-ges y extensión a corteza cerebral.
Sustancia blanca aparentemente normal. 2a.- H&E: discreto aumento de núcleos de oligodendrocitos. 2b.- Tinción IHQ CD163 para macrófagos y glía activada: células salpicadas en el tejido expresan la inmumotinción. 2c.- Tin-ción de LFB: mielina prácticamente normal. 2d.- Tinción IHQ anti-APP: aparente conservación de axones, aunque son ligeramente más finos. 2e y 2f.- y anti CD20 para linfocitos T y B respectivamente: escasa representación de ambas.
Figura 2
la relación entre inflamación y degeneración es muy estrecha y compleja y ambos mecanismos están pre-sentes en todas las fases de la enfermedad, siendo la inflamación la que dirige el proceso degenerativo28.
Teresa Tuñón, Teresa ayuso
a
c
e f
d
b

13
10
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSión
El modelo animal de EM es la encefalomielitis au-toinmune experimental, EAE; a través de este mo-delo conocemos en parte la patogénesis de la EM, así como los mecanismos lesivos y protectores que producen las neuronas en la EM. La degeneración Walleriana por interrupción axonal, es un proceso ac-tivo, como la apoptosis que parece que tanto en hu-manos como en ratas, EM26, lleva a la degeneración axonal distal y retrógrada del soma2.
Daño oxidativoUno de los mecanismos etiopatogénicos que
conllevan una evolución de la enfermedad más des-favorable, es la formación de radicales libres. Estos, se producen por disfunción mitocondrial, por la in-flamación y alteraciones iónicas con acumulación de sodio. Las mitocondrias son las que aportan la mayor cantidad de la energía que consume el tejido. En un estadio inicial solo cambian de forma y es una fase reversible probablemente. A su vez, los radicales li-bres inducen daño definitivo mitocondrial con fraca-so energético y favorecen los depósitos de hierro4, 2, 29. Se ha demostrado recientemente elevado contenido en hierro en el espacio extracelular en núcleos grises profundos de pacientes con EM el cual es captado al interior de las células cuando hay radicales libres. Este alto contenido en hierro, que puede aparecer asi-mismo en otros procesos neurodegenerativos y tam-bién en sujetos de edad avanzada, es responsable en gran medida de la neurodegeneración y contribuye de forma significativa al deterioro funcional global30, 4.
Múltiples mecanismos son, por tanto, responsa-bles que la esclerosis múltiple recurrente-remitente evolucione a progresiva donde predomina la neuro-degeneración y la inflamación, aunque existente, se encuentra “encerrada” detrás de una barrera indemne donde las drogas anti-inflamatorias no tienen acceso. La compensación funcional exhausta, el fracaso del soporte trófico de oligodendrocitos y la activación microglial crónica juegan también un importante papel27, 1. La microglía y los macrófagos, de origen mieloide, son los principales protagonistas en la neu-roinflamación. Ambos tipos celulares pueden, en ra-zón de su plasticidad, tener tanto una función tóxica como protectora. El estímulo son señales medioam-bientales, crisis metabólicas, mayor necesidad ener-gética, moléculas del ambiente tisular o bien control de actividad mediada por las neuronas. El mecanis-mo de actuación se ha estudiado en un modelo expe-rimental de hipoxia31.
RemielinizaciónEn un intento reparador de la lesión, el tejido
nervioso responde con la remielinización de algunas placas. La restauración de la mielina ayuda a prote-
ger los axones y restablecer la conducción saltatoria y la pérdida funcional. Con tinciones de la mielina y también en microscopía electrónica se demuestra que la remielinización se produce a expensas de vainas de mielina más finas y con menor distancia interno-dal. La remielinización que ocurre en la fase precoz va a depender de la oligodendroglía. Hay dos meca-nismos diferentes, el tipo I, en el que la remieliniza-ción va a ser eficaz (70%) y el tipo II (30%) en la que los precursores de los oligodendrocitos no son lo su-ficientemente eficaces y no ayudan a que la mielina se restablezca. En las fases más tardías algunas pla-cas pueden remielinizarse también, lo cual produce el efecto de lo que conocemos como placas en som-bra. Pero en estas fases tardías la remielinización va a estar supeditada a la integridad de los axones, que con frecuencia están más dañados y no ejercen bien su función trófica y reparativa. En las formas progre-sivas la remielinización es muy débil y sin embargo hay progenitores de los oligodendrocitos en las pla-cas7. Se piensa que influyen, además de los anteriores, factores microambientales del tejido nervioso y tam-bién la microglía. La depleción de oligodendrocitos y la remielinización en algunas placas precoces activas ocurre y se produce de forma simultánea10, 32, 33.
En la remielinización hay un factor edad-depen-diente. La eficiencia de la remielinización declina con la edad y los axones desmielinizados que perma-necen sin vainas mielínicas son más susceptibles a la degeneración. El fracaso en la remielinización rela-cionado con la edad puede ser debido a la alteración en la diferenciación de células progenitoras de oligo-dendrocitos. Esta vulnerabilidad axonal es otro de los factores implicados en la progresión de la enferme-dad relacionada con la edad29.
❑ Espectro clínico patológico en la EM: formas clínicas
Se admite que además de la forma clasica de EM, también llamada de Charcot, existen unas variantes como son la forma fulminante de Marburg, la Escle-rosis concéntrica de Baló, la Encefalomielitis aguda diseminada (EAD) y las formas pseudotumorales o tumefactivas.
La Neuromielitis óptica de Devic y formas mo-nosintomáticas como la mielitis transversa longitu-dinalmente extensa, neuritis óptica etc., se ponen en relación con una patogenia distinta mediada por cé-lulas contra el canal de agua Aquaporina-4 expresada en astrocitos34. Pero no siempre son compartimentos estancos y hay formas que se solapan, por lo que se admite que son un espectro de manifestaciones clíni-co-radio-patológicas de las enfermedades inflamato-rias desmielinizantes del SNC.

11
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
te se hacen confluentes. La histología muestra placas desmielinizantes con abundantes macrófagos, edema, daño axonal y presencia de astrocitos gigantes e hiper-tróficos35. Se demuestran depósitos de IgG en las zo-nas lesionadas y depósito del complemento.
La esclerosis concéntrica de Baló es una pecu-liar forma morfológica que con tinciones de mielina muestra capas concéntricas alternando zonas desmie-linizadas con zonas mielinizadas. Las lesiones se lo-calizan en sustancia blanca hemisférica pero también pueden encontrarse en cerebelo, tronco y médula es-pinal. Esta peculiar morfología puede observarse en resonancia y en biopsias (Figura 4). A nivel neuropa-tológico, los anillos concéntricos está en torno a una vénula central rodeada por células inflamatorias mo-nonucleares. Los anillos desmielinizados contienen macrófagos, microglia activada, astrocitos reactivos y pérdida axonal. Otra característica morfológica de la Esclerosis de Balo es su similitud con el patrón in-munopatológico tipo III con apoptosis de oligoden-docitos. Varios mecanismos incluyendo la isquemia por microtrombos de redes capilares o remieliniza-ción pueden ser responsables de la formación de le-siones concéntricas21, 36.
❑ El papel de las biopsias en la EM
De forma ocasional, los pacientes con EM no diag-nosticada, pueden ser intervenidos por los neuro-cirujanos. Ocurre en las formas tumefactivas de la enfermedad, cuya apariencia en la neuroimagen re-meda un tumor37 (Figura 5). Incluso al microscopio, en biopsia intraoperatoria, pueden dar lugar a error por la presencia de las células de Creutzfelt-Peters que son astrocitos con fraccionamiento del núcleo, que podrían ser confundidos con mitosis38. Conviene saberlo pero quizás el nombre de la célula sea tan di-fícil de aprender como encontrarla en el tejido. Los que caracteriza a las formas tumefactivas es la gran cantidad de macrófagos con citoplasma hinchado, a veces el núcleo está desplazado que se confunden con las células en anillo de sello de los algunos tu-mores como los carcinomas gástricos. Es útil hacer inmunotinción de queratinas, que resultará negativa, e identificar que se trata de macrófagos fagocitando la mielina resultando positivos para el antígeno de membrana epitelial, EMA y la correspondiente ex-presión positiva de marcadores de microglía y ma-crófagos, CD68, CD163. Se acompaña de una po-blación variable de linfocitos con inmunofenotipo T, CD5+ y CD3+ (Figura 5).
Los cambios que observamos al microscopio, igual que la patogenia de la enfermedad, no son de-bidos a un mecanismo lesional único, sino a diferen-tes vías o mecanismos interrelacionados entre sí. Las
Lesión tumefactiva. 5a y 5b.-: biopsia de masa cerebral con sospecha tumoral. Tinción de H&E que de-muestra células macrofágicas y microglía con morfología en anillo de sello en un contesto inflamatorio. 5c.- Tinción IHQ para EMA, que se expresa los citoplasmas celulares a modo de “panza”. 5d.- El paciente tenía una lesión hemisférica subcortical sin edema acompañante. (Tuñón Álvarez T y Mendióroz M 2002).
Esclerosis concéntrica de Baló. 4a.- LFB para mielina: destrucción de mielina la cual se pone de manifiesto en el interior macrófagos. 4b.- H&E: numerosos macrófagos espumosos alrededor de una vena. 4c.- H&E: bandas de mielina normal alternando con otras con fagocitosis y des-mielinización. 4d.- Mayor aumento. 4e.- Proteína básica de la mielina (PBM): inmunotinción que identifica alternancia de mielina parcialmente conservada, con restos mielínicos. 4f.- Inmunotinción de proteína glial fibrilar ácida. 4g.- CD3: linfocitos T. 4h.- CD20: linfocitos B. Imágenes centrales de RM craneal en donde se pueden observar los halos concén-tricos de destrucción alternante de la mielina.
Figura 4
Figura 5
La forma fulminante descrita por Otto Marburg en 1906, es muy agresiva, monofásica, falleciendo los pacientes antes del año. Se caracteriza por lesio-nes diseminadas que pueden comenzar en hemisferios o en troncoencéfalo y en RM aparece como lesiones de hiperseñal que aumentan de tamaño y rápidamen-
Teresa Tuñón, Teresa ayuso

13
12
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSión
BiBliografía
1.- Frischer JM, Bramow S, Dal-Bianco A, Lucchinetti CF, Rauschka H, Schmidbauer M, Laursen H, Sorensen PS, Lassmann H. The relation between inflammation and neurodegeneration in multiple sclerosis brains. Brain 2009:132;1175-89.
2.- Stadelmann C. Multiple sclerosis as a neurodegenerative disease: pathology, mechanisms and therapeutic implications. Current Opinion in Neurology 2011;24:224-9.
3.- Kuhle J, Petzold A, Regeniter A, Schindler C, Mehling M, Anthony DC, Kappos L, Lindberg RL. Neurofilament heavy chain in CSF correlates with relapses and disability in multiple sclerosis. Neurology 2011;76:1206-13.
4.- Friese MA, Schattling B, Fugger L. Mechanisms of neurodegeneration and axonal dysfunction in multiple sclerosis. Nat Rev Neurol 2014;10:225-38.
5.- Lucchinetti C, Brück W, Parisi J, Scheithauer B, Rodriguez M, Lassmann H. Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination. Ann Neurol 2000;47:707-17.
6.- Lassmann H, van Horssen J, Mahad D. Progressive multiple sclerosis: pathology and pathogenesis. Nat Rev Neurol 2012;8(11):647-56.
7.- Chang A, Tourtellotte WW, Rudick R, Trapp BD. Premyelinating oligodendrocytes in chronic lesiones of multiple scle-rosis. N Engl J Med 2002;346:165-73.
8.- Barnett MH, Prineas JW. Relapsing and remitting multiple sclerosis: pathology of the newly forming lesion. Ann Neurol 2004;55:458-68.
9.- Pittock SJ, Lucchinetti CF, The Pathology of MS. New Insights and Potential Clinical Applications. The Neurologist 2007;13;Number2.
10.- Lassmann H, Brück W, Lucchinetti C. The Immunopathology of Multiple Sclerosis: An Overview. Brain Pathol 2007;17:210-8.
11.- Bjartmar C, Wujek JR, Trapp BD. Axonal loss in the pathology of MS: consequences for understanding the progressive phase of the disease. J Neurol Sci 2003;206:165-71.
12.- Schirmer L, Antel JP, Bruck W, Stadelmann C. Axonal loss and neurofilament phosphorylation changes accompany le-sion development and clinical progression in multiple sclerosis. Brain Pathol 2011;21(4):428-40.
13.- Owens T. The enigma of multiple sclerosis: inflammation and neurodegeneration cause heterogeneous dysfunction and damage. Curr Opin Neurol 2003;16(3):259-65.
14.- Filippi M, Rocca MA, Barkhof F, Brück W, Chen JT, Comi G, DeLuca G, De Stefano N, Erickson BJ, Evangelou N, Fazekas F, Geurts JJ, Lucchinetti C, Miller DH, Pelletier D, Popescu BF, Lassmann H; Attendees of the Correlation between Pathological MRI findings in MS workshop. Association between pathological and MRI findings in multiple sclerosis. Lancet Neurol 2012; 11(4):394-60.
15.- Healy BC, Arora A, Hayden DL, Ceccarelli A, Tauhid SS, Neema M, Bakshi R. Approaches to normalization of spinal cord volume: application to multiple sclerosis. J Neuroimaging. 2012;22(3):12-9.
16.- DeLuca GC, Williams K, Evangelou N, Ebers GC, Esiri MM. The contribution of demyelination to axonal loss in multi-ple sclerosis. Brain 2006;129:1507-16.
17.- Kuhlmann T. Relapsing–remitting and primary progressive MS have the same cause(s)- the neuropathologist’s view: 2 Multiple Sclerosis Journal 2013;19(3):268-9.
18.- Anderson VM, Fox NC, Miller DH. Magnetic resonance imaging measures of brain atrophy in multiple sclerosis. J Magn Reson Imaging 2006;23:605-18.
19.- Trentini A, Comabella M, Tintoré M, Koel-Simmelink MJ, Killestein J, Roos B, Rovira A, Korth C, Ottis P, Blankenstein MA, Montalban X, Bellini T, Teunissen CE. N-acetylaspartate and neurofilaments as biomarkers of axonal damage in patients with progressive forms of multiple sclerosis. J Neurol 2014;261(12):2338-43.
células inflamatorias entran el tejido nervioso acu-diendo a la llamada de algún desconocido que le abre la BHE y le incita a destruir la mielina y a producir daño en el axón. Ambos, se defienden como pue-den y habiendo cohabitado en armonía, buscan alia-dos para competir por un territorio común. Cuando el ejército compuesto por las células inflamatorias, macrófagos y microgía quiere retirar sus tropas ya es tarde. Pide refuerzos y éstos no llegan. La BHE está cerrada. Han sido sometidas a una encerrona.
❑ Agradecimientos
A todos los pacientes con esclerosis múltiple, espe-cialmente a aquellos que donaron su cerebro para investigación. A Pitu Manubens, Federico Gª Bra-gado, a neurólogos, patólogos, geriatras y gestores del Complejo hospitalario de Navarra. Cada uno desde su puesto hace posible que el Banco de teji-dos neurológicos continúe la tarea de aportar salud a la sociedad.

13
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
20.- Llufriu S, Kornak J, Ratiney H, Oh J, Brenneman D, Cree BA, Sampat M, Hauser SL, Nelson SJ, Pelletier D. Magnetic resonance spectroscopy markers of disease progression in multiple sclerosis. JAMA Neurol 2014 Jul 1;71(7):840-7.
21.- Popescu B. F. & Lucchinetti, C. F. Pathology of demyelinating diseases. Annu. Rev. Pathol. 7, 185–217 (2012).22.- Kutzelnigg A, Lassmann H. Cortical demyelination in multiple sclerosis: a substrate for cognitive deficits? J Neurol Sci
2006;245:123-6.23.- Peterson JW, Bö L, Mörk S, Chang A, Trapp BD. Transected neurites, apoptotic neurons, and reduced inflammation in
cortical multiple sclerosis lesions. Ann Neurol 2001;50:389-400.24.- Vercellino M, Plano F, Votta B, Mutani R, Giordana MT, Cavalla P. Grey matter pathology in multiple sclerosis. J Neu-
ropathol Exp Neurol 2005;64:1101-7.25.- Choi SR, Howell OW, Carassiti D, Magliozzi R, Gveric D, Muraro PA, Nicholas R, Roncaroli F, Reynolds R. Meningeal
inflammation plays a role in the pathology of primary progressive multiple sclerosis. Brain 2012;135:2925-37.26.- Howell OW, Reeves CA, Nicholas R, Carassiti D, Radotra B, Gentleman SM, Serafini B, Aloisi F, Roncaroli F, Magl-
iozzi R, Reynolds R. Meningeal inflammation is widespread and linked to cortical pathology in multiple Brain. 2011;134(Pt ):2755-71.
27.- Magliozzi R, Howell OW, Reeves C, et al. A gradient of neuronal loss and meningeal inflammation in multiple sclerosis. Ann Neurol 2010;68:477-93.
28.- Lassmann H. What drives disease in multiple sclerosis: Inflammation or neurodegeneration? Clinical and Experimental Neuroimmunology 2010;1:2-11.
29.- Franklin RJM, Ffrench-Constant C, Edgar JM and Smith KJ. Neuroprotection and repair in multiple sclerosis. Nat Rev Neurol 2012;8:624-34.
30.- Haider L, Simeonidou C, Steinberger G, Hametner S, Grigoriadis N, Deretzi G, Kovacs GG, A Kutzelnigg A, Lassmann H, Frischer JM. Multiple sclerosis deep grey matter: the relation between demyelination, neurodegeneration, inflam-mation and iron. J Neurol Neurosurg Psychiatry 2014;0:1-10. doi:10.1136/jnnp-2014-307712.
31.- Fumagalli S, Perego C, Pischiutta F, Zanier ER and De Simoni MG. The ischemic environment drives microglia and macrophage function. Frontiers in Neurology | Neurodegeneration 2015;6:Article 81. doi: 10.3389/fneur.2015.00081.
32.- Glezer I, Lapointe A, Rivest S. Innate immunity triggers oligodendrocyte progenitor reactivity and confines damages to brain injuries. FASEB J 2006;20:750-2.
33.- Foote AK, BlakemoreWF. Inflammation stimulates remyelination in areas of chronic demyelination. Brain 2005;128:528-39.
34.- Pittock SJ, Weinshenker BG, Lucchinetti CF, Wingerchuk DM, Corboy JR, Lennon VA. Neuromyelitis optica brain le-sions localized at sites of high aquaporin 4 expression. Arch. Neurol 2006;63:964-8.
35.- Megan R, Rahmlow MD, Orhun K. MD1. Fulminant Demyelinating Diseases. The Neurohospitalist. 2013;3(2):81-91.36.- Stadelmann C, Ludwin S, Tabira T, Guseo A, Lucchinetti CF et al. Tissue preconditioning may explain concentric lesions
in Balo´’s type of multiple sclerosis. Brain 2005;128:979-87.37.- Tuñon Álvarez T, Mendioroz M. Neuropatología de la esclerosis múltiple. Timely Topics in Medicine-Neurology
2002;(Prous Science Publisher, Barcelona):1-7.38.- Lucchinetti CF, Gavrilova RH, Metz I, Parisi JE, Scheithauer BW, Weigand S, et al. Clinical and radiographic spectrum
of pathologically confirmed tumefactive multiple sclerosis. Brain 2008;131:1759-75.
Teresa Tuñón, Teresa ayuso

13
14
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSiónrEviSión
Natalizumab en intervalo expandido de dosis en pacientes con esclerosis múltiple José VicenTe HerVás García1, Laia Grau López2, ane Miren crespo cueVas2, crisTina raMo TeLLo1
1Unidad de Esclerosis Múltiple, Servicio de Neurología. Departamento de Neurociencias. 2Servicio de Neurología. Departamento de Neurociencias. Hospital Germans Trias i Pujol. Badalona (Barcelona).
RESUMEN. El natalizumab es un fármaco muy eficaz para el tratamiento de la esclerosis múltiple remitente-recurrente. Presentamos nuestra experiencia en la utilización de intervalo expandido de dosis de natalizumab (cada 6 semanas) respecto a variables clínicas, ra-diológicas, serológicas y económicas.Palabras clave: coste farmacéutico, eficacia, esclerosis múltiple, intervalo expandido de dosis, leucoencefalopatía multifocal progresiva, na-talizumab.
ABSTRACT. Natalizumab is a very effective drug to the treatment of the relapsing-remitting multiple sclerosis. We present our experience of expanded-interval dose of natalizumab (every 6 weeks) respect to clinical, radiological, serological and economical variables. Key words: efficacy, expanded-interval dose, multiple sclerosis, natalizumab, pharmaceutical cost, progressive multifocal leukoencephalop.
atalizumab (NTZ) es un anticuerpo monoclonal fren-te a la integrina VLA-4. Esta integrina permite al lin-focito unirse al endotelio y atravesar la barrera hema-toencefálica para llegar al sistema nervioso central (SNC). El fármaco actúa evitando esta unión y, por lo tanto, el paso de los linfocitos al SNC. NTZ está indicado para el tratamiento de la esclerosis múltiple remitente-recurrente (EMRR) de inicio agresivo o que falla a otros tratamientos. Los estudios pivotales han demostrado que, a la dosis estándar (NTZ_DE) intravenosa de 300mg/4 semanas, se muestra muy eficaz en la reducción de la tasa de brotes, la pro-gresión de la discapacidad y la actividad en la RM cerebral1. Además, los resultados en estudios post-comercialización han mostrado una efectividad ma-yor, hablándose por primera vez de pacientes libres de enfermedad2-4.
Existen varios trabajos donde se observa que la utilización del intervalo expandido de dosis (NTZ_IDE) a 6 u 8 semanas no disminuye la eficacia del fármaco5-8. Además, algunos autores han sugerido que podría ser una estrategia para disminuir el riesgo de leucoencefalopatía multifocal progresiva (LMP) al permitir mayor paso de linfocitos al SNC6, 8. A su vez, supondría un menor coste farmacéutico.
El objetivo de nuestro trabajo es presentar nues-tra experiencia con el uso de NTZ_IDE/6 semanas.
❑ Material y métodos
Se trata de un estudio descriptivo, unicéntrico y pros-pectivo de 3 años de evolución (mayo 2012-mayo 2015) realizado en una Unidad de Esclerosis Múl-tiple. Se incluyeron pacientes con EMRR en trata-
miento con NTZ_DE durante al menos 13 meses que aceptaron el cambio a NTZ_IDE. El protocolo fue aprobado por el Servicio de Farmacia y la Dirección del centro. Todos los pacientes firmaron el consen-timiento informado. Se analizaron las siguientes va-riables: 1) demográficas; 2) clínicas: tasa anualizada de brotes (TAB); discapacidad evaluada mediante la escala EDSS y efectos adversos en tres tiempos: an-tes de iniciar el tratamiento con NTZ y durante el tra-tamiento con NTZ_DE y NTZ_IDE; 3) radiológicas: número de lesiones captantes de gadolinio (T1Gd+) y nuevas lesiones en secuencias T2 y T2 FLAIR en RM cerebral, con frecuencia trimestral para pacien-tes con 2 o más factores de riesgo de LMP, y anual para el resto de pacientes; 4) serológicas: serología frente al virus JC (VJC) al menos una vez al año; 5) económicas: coste de cada régimen de dosis.
Análisis estadísticoSe realizó la estadística descriptiva (media, des-
viación estándar, tablas de frecuencia y estimación del riesgo) de las principales variables. Se realizó una comparación de medias mediante un T-Test para comparar medidas cuantitativas entre dos grupos. Los datos se recogieron y analizaron mediante el pa-quete estadístico SPSS versión 18.0. En todos los ca-sos se admitió significación estadística para p<0.05.
❑ Resultados
Características basales de la muestra (Tabla I)Se incluyeron 16 pacientes. Once (69%) fueron
mujeres. Edad media: 43 ± 9 años. Tiempo de evo-lución de la enfermedad antes del inicio de NTZ_
N
Corre
spon
denc
e: Jo
sé V
icent
e Her
vás G
arcía
– U
nida
d de
Esc
leros
is M
últip
le –
Serv
icio
de N
euro
logí
a – D
epar
tam
ento
de N
euro
cienc
ias
Hosp
ital G
erm
ans T
rias i
Puj
ol –
Ctra
. Can
yet,
s/n
– 08
916
Bada
lona
– T
eléfo
no: 9
34 9
78 4
33 –
E-m
ail: j
osev
icent
e.her
vas.g
arcia
@gm
ail.co
m

15
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
DE: 9 ± 7.3 años. Antes de iniciar NTZ la TAB fue de 2.25, la EDSS de 4 ± 1.5 y 63% tenían lesiones T1Gd (+). Doce pacientes (75%) habían recibido tra-tamiento inmunomodulador previo, uno de ellos in-munosupresor. Duración media de NTZ_DE: 3.5 ± 1.9 años. Duración media de NTZ_IDE: 1.5 ± 0.43. Tiempo medio total de tratamiento con NTZ: 5 ± 1.9 años. Seis pacientes (37,5%) llevaban al menos 2 años con NTZ_IDE. Once (69%) pacientes fueron VJC (+); el resto negativos.
Variables clínicasCon NTZ_DE 2 pacientes presentaron 1 brote.
La TAB disminuyó de 2.21 a 0.025, lo que supone una disminución del 99% (p<0.001). Ningún pacien-te tuvo brotes con NTZ_IDE (Figura 1a).
Bajo NTZ_DE la EDSS pasó de 4.0 ± 1.5 a 3.7 ± 1.8 (p=0.4). Tras NTZ_IDE la EDSS se mantuvo estable 3.6 ± 1.9 (Figura 1b).
Con NTZ_IDE hubo un caso de LMP confir-mado por RM cerebral y PCR-VJC (+) en LCR. No hubo ningún otro efecto adverso grave en ninguno de los dos regímenes de dosis.
Variables serológicasNo hubo ninguna seroconversión y el índex se
mantuvo estable a lo largo del tratamiento tanto en NTZ_DE como en NTZ_IDE.
Variables radiológicasNo hubo nuevas lesiones en T2 en las RM cere-
brales de seguimiento en ningún régimen de dosis. En 1 paciente (6%) en tratamiento con NTZ_DE se objetivaron lesiones T1Gd+. No hubo ninguna lesión T1Gd+ en pacientes con NTZ_IDE (Figura 2).
Doce pacientes (75%) en NTZ_DE y 15 (94%) en NTZ_IDE permanecieron libres de enfermedad durante todo el tratamiento cumpliendo criterios NEDA-3 (no brotes, no aumento de la discapacidad, no nuevas lesiones en T2 ni T1Gd+).
Análisis del coste farmacéuticoAnalizando el coste directo del fármaco y los
costes indirectos derivados de su administración (tra-bajo de enfermería, horas de trabajo, transporte de los pacientes...) se consiguió un ahorro de 6.548 € brutos anuales por paciente.
❑ Discusión
Presentamos un estudio descriptivo de la evolu-ción de 16 pacientes con EMRR en tratamiento con NTZ_IDE cada 6 semanas que previamente habían sido tratados con NTZ_DE. A pesar de la disminu-ción de la frecuencia de administración, los pacientes
con NTZ_DE continuaron sin actividad clínica ni ra-diológica.
Existen varios trabajos publicados y presenta-ciones en congresos internacionales que apoyan el tratamiento con NTZ_IDE usado cada 6 u 8 sema-nas5-8. Bomprezzi R y Pawate S, publicaron recien-temente la experiencia de 361 pacientes tratados con NTZ_DE en 2 centros de Estados Unidos (EEUU) que cambiaban tras mínimo 6 meses de NTZ_DE a NTZ_IDE (6 u 8 semanas). Tras una media en NTZ_IDE de 20 ± 11 meses, no encontraron diferencias significativas en la TAB de ambos regímenes de do-sis; además, el número de nuevas lesiones en RM se mantuvo estable5.
Ryerson et al. compararon la eficacia entre NTZ_DE en 1078 pacientes y NTZ_IDE (desde 4 se-manas + 3 días a 8 semanas + 5 días) en 886 pacien-tes en 10 centros de EEUU y no encontraron diferen-cias entre ambos regímenes de dosis en TAB, nuevas lesiones en RM ni en la combinación de parámetros clínicos y de RM. Concluyeron que el NTZ_IDE no afectaba a la eficacia del NTZ y animaban a incluir pacientes en ambos regímenes de dosis8.
Han sido comunicadas otras experiencias con NTZ_IDE a intervalos de dosificación más largos. En el estudio REFINE, Trojano et al. describieron su experiencia en pacientes tratados con NTZ_IDE cada 12 semanas que habían recibido al menos NTZ_DE durante 12 meses y no habían presentado brotes en
t_DE (tiempo de tratamiento en dosis estándar), t_IDE (tiempo de tratamiento en intervalo de dosis expandido), VJC (serología Virus JC), TAB (tasa anualizada de brotes), T1Gd+ (lesiones captantes de gadolinio en RM cerebral).
Características basales
n = 16
Edad (años) 43 ± 9
Sexo femenino 11 (69)
t evolución
t_DE (años) 9 ± 7.3
t_IDE (años) 12.5 ± 7.5
Tratamiento previo 4 naïve, 9 IFNβ, 2 acetato de glatirámero, 1 azatioprina
VJC 5 VJC-, 4 VJC+ (índex <1.5), 7 VJC+ (índex >1.5)
TAB 2.25
EDSS basal 4 ± 1.5
T1Gd+ basal (n= 11) 7 (63)
Lesiones en T2 (n= 15) <9 lesiones >9 lesiones
1 (7)14 (93)
TABLA I
José VicenTe HerVás García, Laia Grau López, ane Miren crespo cueVas, crisTina raMo TeLLo

13
16
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSión
el último año. Los pacientes fueron randomizados a varios regímenes de dosificación: 300mg/4 sema-nas IV (54 pacientes), NTZ 300mg/4 semanas sc (45 pacientes), NTZ 300mg/12 semanas IV (52 pa-cientes), NTZ 300mg/12 semanas sc (54 pacientes), NTZ 150mg/12 semanas IV (47 pacientes), NTZ 150mg/12 semanas sc (38 pacientes). Los brazos de NTZ_IDE a 12 semanas fueron interrumpidos de for-ma precoz por aumento de la actividad de la enfer-medad tanto clínica como radiológica9.
Es importante tener en cuenta que la actividad de la enfermedad es mayor al inicio y va disminuyen-do conforme aumenta el tiempo de evolución de la enfermedad. Esto podría sobreestimar la eficacia del tratamiento con NTZ_IDE.
Con respecto al riesgo de desarrollo de LMP, además de la serología VJC (+) y el tratamiento in-munosupresor previo, uno de los factores que au-menta el riesgo de esta infección oportunista es el tratamiento NTZ_DE por más de 2 años10. Con el ob-jetivo de disminuir el riesgo de LMP se han llevado a cabo varias estrategias: suspensión transitoria de la medicación o vacaciones terapéuticas11, sustitución de NTZ por fármacos más seguros pero menos efica-ces12 y, como en nuestro caso, el uso de NTZ_IDE6, 8.
Las 2 primeras estrategias no han conseguido de-mostrar un control de la actividad de la enfermedad. Kerbrat A et al. describieron su experiencia tras re-tirada del tratamiento con NTZ_DE en 27 pacientes muy activos (TAB 2.3 con actividad radiológica en el 78%). Tras 6 meses sin recibir ningún tratamien-to modificador, el 63% de los pacientes presentaron brotes y el 15% sufrieron fenómeno de “rebound” con brotes graves y más de 20 lesiones T1Gd (+)11. En relación al cambio de medicación, el estudio RESTORE mostró que los pacientes que están bajo tratamiento con NTZ que cambiaron a IFNb-1a IM, acetato de glatirámero sc o metilprednisolona, pre-sentaron actividad clínica y radiológica a los 2-3 me-ses de la retirada de NTZ que no fue vista en los que continuaron con el tratamiento12. Debido a estos re-sultados, estas estrategias no son recomendables con el objetivo de disminuir la LMP.
La última estrategia para disminuir el riesgo de LMP sería la utilización de NTZ_IDE. Al expandir el intervalo de dosis podría disminuir la concentración de NTZ sérica y, así, disminuir la saturación de su dia-na farmacológica (VLA-4). Esto permitiría una mayor entrada de linfocitos al SNC y disminuir el riesgo de LMP al aumentar la inmunovigilancia, sin aumentar la actividad de la enfermedad. Ryerson et al. comunica-ron 2 casos de LMP en NTZ_DE y ninguno en NTZ_IDE. Los autores concluyen que existe una tendencia favorable para evitar la LMP en NTZ_IDE, aunque no se consiguió la significación estadística8.
Actividad clínica. Figura 1a: la tasa anualiza-da de brotes disminuyó significativamente de 2.21 a 0.025 (p<0.01) con dosis estándar de natalizumab y se mantuvo al cambiar a intervalo expandido de dosis. Figura 1b: la dis-capacidad se mantuvo estable (p=0.4). TAB: tasa anualiza-da de brotes; NTZ_DE: tratamiento con natalizumab a dosis estándar; NTZ_IDE: tratamiento con intervalo expandido de dosis de natalizumab; EDSSb: EDSS al inicio del tratamiento con natalizumab; EDSS_DE: EDSS al finalizar tratamiento con dosis estándar de natalizumab; EDSS_IDE: EDSS en tratamiento con intervalo expandido de dosis.
Actividad radiológica. Tras el uso de natalizu-mab a dosis estándar disminuyeron las lesiones captantes de gadolinio. Esta disminución se mantuvo tras el cambio a intervalo expandido de dosis. T1Gd+: lesiones captantes de gadolinio, T1Gd+_DE: lesiones captantes de gadolinio durante el tratamiento con dosis estándar de natalizumab, T1Gd+_IDE: lesions captantes de gadolinio durante el trata-miento con intervalo expandido de dosis.
Figura 1
Figura 2
a
b

17
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
En resumen, en nuestra serie, el cambio de NTZ_DE a NTZ_IDE no aumentó la actividad clí-nica ni radiológica de la enfermedad. No existen ensayos clínicos que evalúen el uso de NTZ_IDE por lo que su implementación es cuestionable. Creemos, por la experiencia comunicada por otros autores, que el uso de NTZ_IDE es una estrategia válida para disminuir el riesgo de LMP. Considera-
mos que el caso de LMP en NTZ_IDE que presen-tamos no invalida esta teoría, y que en el análisis de factores asociados al NTZ_IDE, como el grado de saturación de su receptor biológico (VLA-4)13, la correlación con el índice de masa corporal14-16, y la concentración de NTZ14, 17 puede estar la clave. Esta estrategia se muestra útil para optimización del gas-to farmacéutico.
BiBliografía
1.- Polman CH, O’Connor PW, Havrdova E, Hutchinson M, Kappos L, Miller DH, et al. A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med 2006;354:899-910.
2.- Butzkueven H, Kappos L, Pellegrini F, Trojano M, Wjendl H, Patel RN, et al. Efficacy and safety of natalizumab in mul-tiple sclerosis: interim observational programme results. J Neurol Neurosurg Psychiatry 2014;85:1190-7.
3.- O’Connor P, Goodman A, Kappos L, Lublin F, Polman C, Rudick RA, et al. Long-term safety and effectiveness of natali-zumab redosing and treatment in the STRATA MS Study. Neurology 2014;83:78-86.
4.- Havrdova E, Galetta S, Hutchinson M, Stefoski D, Bates D, Polman CH, et al. Effect of natalizumab on clinical and radiological disease activity in multiple sclerosis: a retrospective analysis of the Natalizumab Safety and Efficacy in Relapsing-Remitting Multiple Sclerosis (AFFIRM) study. Lancet Neurol 2009;8 (3):254-60.
5.- Bomprezzi R, Pawate S. Extended interval dosing of natalizumab: a two-center, 7-year experience. Ther Adv Neurol Disord 2014;7:227-31.
6.- Herbert J, Ryerson LZ, Tornatore C, Foley J, Weinstock-Guttman B, Kister I, et al. Multicenter retrospective study of extended dosing of natalizumab in multiple sclerosis: a strategy for mitigating risk of progressive multifocal leukoen-cephalopathy while maintaining efficacy? American Academy of neurology. Philadelphia, PA, USA, 2014.
7.- Ryerson LZ, Herbert J, Tornatore C. Efficacy of a natalizumab extended dosing in multiple sclerosis: a retrospective multicenter analysis. ACTRIMS-ECTRIMS. Boston, MA, USA, 2014.
8.- Ryerson LZ, Herber J, Foley J, Weinstock-Guttman B, Tornatore C, Pawate S, et al. Safety and efficacy of extended dose natalizumab in multiple sclerosis: an ongoing multicenter study. American Academy of neurology. Washington DC, USA, 2015.
9.- Trojano M, Ramió-Torrentà L, Grimaldi LME, Lubetzki C, Schippling S, Evans K, et al. Subcutaneous natalizumab 300mg every 4 weeks is comparable to standard intravenous dosing in REFINE: a study exploring the safety, toler-ability, and efficacy of multiple natalizumab treatment regimens in patients with relapsing multiple sclerosis. Ameri-can Academy of neurology. Washington DC, USA, 2015.
10.- Bloomgren G, Richman S, Hotermans C, Subramanyam M, Goelz S, Natarajan A, et al. Risk of natalizumab-associated progressive multifocal leukoencephalopathy. N Engl J Med 2012;366:1870-80.
11.- Kerbrat A, Le Page E, Leray E, Anani T, Coustans M, Desormeaux C, et al. Natalizumab and drug holiday in clinical practice: an observational study in very active relapsing remitting multiple sclerosis patients. J Neurol Sci 2011;308(1-2):98-102.
12.- Fox RJ, Cree BA, De Sèze J, Gold R, Hartung HP, Jeffery D, et al. MS disease activity in RESTORE: a randomized 24-week natalizumab treatment interruption study. Neurology 2014;82(17):1491-8.
13.- Harrer A, Pilz G, Einhaeupl M, Oppermann K, Hitzl W, Wipfler P, et al. Lymphocyte substes show different response patterns to in vivo bound natalizumab-a flow cytometric study on patients with multiple sclerosis. PLoS One 2012;7(2):e31784.
14.- Foley J, Mezger R, Hoyt T, Christensen A. The effect of extended interval dosing and patient weight on long term natali-zumab Pharmacokinetics. American Academy of neurology. Washington D.C, USA, 2015.
15.- Foley J, Gudesblatt M, Zarif M, Lathi E. Low Body weight as a potential surrogate risk factor for progressive multifocal leukoencephalopathy. American Academy of Neurology. Philadelphia, PA, USA, 2014.
16.- Foley J, Christensen A, Hoyt T. Body mass and natalizumab concentration as potential risk stratification markers for drug-related PML. ECTRIMS. Lyon, France, 2012.
17.- Foley J, Metzger R, Hoyt T, Christensen A. Optimizing the natalizumab dose interval to reduce PML Risk-lessons from the pharmacokinetics of therapy discontinuation. American Academy of neurology. Washington DC, USA, 2015.
José VicenTe HerVás García, Laia Grau López, ane Miren crespo cueVas, crisTina raMo TeLLo

13
18
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSión
Bases para un algoritmo terapéutico en esclerosis múltipleLuis BrieVa ruizJefe Sección de Neurología. Hospital Universitario Arnau de Vilanova.Lleida.
RESUMEN. Las últimas 2 décadas han proporcionado notables avances en el tratamiento de la esclerosis múltiple (EM) sobre la base del conocimiento de la patobiología de la enfermedad que incluye mecanismos inflamatorios y neurodegenerativos que afectan a la sustan-cia blanca y sustancia gris. Si bien no existe una cura para la EM, se dispone en la actualidad de numerosos fármacos modificadores de la EM con diferente perfil de eficacia-riesgo aunque su beneficio a largo plazo no está claro. Esto unido a la falta de biomarcadores pro-nósticos de la EM y de eficacia-seguridad de cada tratamiento de forma individualizada ha motivado que la toma de decisiones terapéuti-cas sea cada vez más compleja. Se hace necesario un plan terapéutico individual desde el inicio y una estrecha monitorización tanto de la eficacia a nivel clínico y radiológico como de la seguridad, tolerancia y adherencia. Siguen siendo cuestiones a debate cuál es el fármaco más adecuado al inicio y a lo largo de la enfermedad, cuándo cambiar por respuesta subóptima y cuál es la alternativa más adecuada.Palabras clave: esclerosis múltiple, tratamiento, algoritmo terapéutico, respuesta subóptima.
ABSTRACT. The last two decades have provided significant advances in the treatment of multiple sclerosis (MS) on the basis of knowled-ge of the pathobiology of the disease, including inflammatory and neurodegenerative mechanisms affecting the white matter and gray matter. While there is no cure for MS, we have many disease-modifying drugs currently available with different profit - risk profile although its long-term benefit is unclear. This point together with the lack of MS prognostic and other efficacy-safety biomarkers for each particular treatment has prompted the therapeutic decision-making is increasingly complex. An individual treatment plan is ne-cessary from the onset and close monitoring of both the clinical and radiological efficacy and the safety, tolerability and adherence to treatment. Important questions remain about the most appropriate drug at onset and throughout the disease, the right timing to switch by suboptimal response and what is the most suitable alternative drug.Key words: multiple sclerosis treatment, treatment algorithm, suboptimal response.
E l objetivo principal de la terapia en esclerosis múlti-ple (EM) es modificar la historia natural de la enfer-medad, la reducción de la actividad inflamatoria en el sistema nervioso central (CNS), y la prevención o re-traso de la progresión de la discapacidad neurológica.
La parte inflamatoria y la neurodegenerativa de la EM expresada por brotes y progresión de la dis-capacidad respectivamente están probablemente pro-movidas por diferentes mecanismos1. En el examen de una de las mayores cohortes patológicas de casos de esclerosis múltiple se demostró la falta de correla-ción entre la carga de lesión encefálica y la pérdida axonal en los tractos corticoespinales de la médula espinal, donde típicamente se localizan los fenóme-nos clínicos que caracterizan la fase progresiva2.
Varios estudios de historia natural en EM han demostrado de forma convincente que, si bien la duración para llegar a una incapacidad moderada, definida por una discapacidad medida por EDSS de 3–43 es muy variable entre los pacientes, el intervalo de tiempo que va del EDSS 3 al EDSS 6 es homogé-neo con independencia del tiempo transcurrido hasta alcanzar el primer tramo hasta un EDSS 3 y la pre-sencia o no de brotes4. La primera fase corresponde
a la inflamatoria donde predomina la inmunidad ad-quirida y sobre la que los tratamientos actuales han demostrado beneficio. La segunda fase corresponde con la degenerativa donde predomina la acción de la inmunidad innata y los tratamientos actuales no han demostrado beneficio5. Esta observación tiene impli-caciones directas en la estrategia de tratamiento. La primera fase donde predomina la inflamación clínica y radiológicamente, hasta alcanzar EDSS 3, se ha de-nominado “ventana terapéutica”6 y es donde existe la oportunidad de personalizar el tratamiento para evi-tar la inflamación y tratar de influir en la discapaci-dad a largo plazo.
Con la disponibilidad de tratamientos más poten-tes han aumentado las expectativas del control abso-luto de la inflamación en la EM que se ha dado en denominar NEDA7: “no evidence of disease activity” y que está basado en 3 variables: ausencia de brotes, de progresión de la discapacidad y de actividad ra-diológica entendida como lesiones nuevas o aumen-tadas en T2 y/o lesiones captantes de Gadolinio. Se puede extender el término considerando la atrofia como actividad radiológica (NEDA-4) así como los cambios neuropsicológicos y la fatiga como activi-
Corre
spon
denc
ia: L
uis B
rieva
Rui
z – H
ospi
tal U
nive
rsita
rio A
rnau
de V
ilano
va –
Avd
a. Ro
vira R
oure
, 80
2519
8 Ll
eida –
Telé
fono
: 97
3 70
5 20
0 –
E-m
ail: l
briev
a.llei
da.ic
s@ge
ncat
.cat

19
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
Luis BrieVa ruiz
dad clínica8 pudiendo extender este concepto casi de forma indefinida.
Un estudio longitudinal reciente sobre el estado de NEDA-3 mostró que aunque el 46% de los pa-cientes tenían NEDA después del primer año, sólo el 8% lo mantenían después de 7 años9. Según estos datos, la decisión de cambio de tratamiento basada únicamente en el mantenimiento de NEDA requeriría un escalado terapéutico en casi todos los pacientes en unos pocos años. Es más lógico, por tanto, aplicar NEDA de una forma flexible dando un valor relativo a cada concepto e individualizando en el contexto del paciente concreto incluyendo comorbilidad y riesgo con las posibles alternativas terapéuticas disponi-bles. En cualquier caso, una vez clara la necesidad de cambio de tratamiento la optimización debe hacerse tan pronto como sea posible. Se sabe que la falta de control de la actividad inflamatoria al inicio contri-buye a la discapacidad a largo plazo pero se descono-ce si el control absoluto de la actividad inflamatoria es capaz de retrasar la fase degenerativa.
Las terapias modificadoras de la enfermedad de primera generación que incluyen interferón-β (IFN-b) y acetato de glatiramer (AG) disminuyen la infla-mación del SNC y son más eficaces cuando se usan en las fases precoces10, 11. El tratamiento es menos eficaz en la esclerosis múltiple secundaria progresiva (EMSP)12, 13, cuando los procesos neurodegenerativos se muestran determinantes en la progresión de la dis-capacidad. En función del tiempo de evolución de la enfermedad, el grado de discapacidad alcanzado y la presencia o no de actividad clínica o radiológica se puede valorar cuánta inflamación y/o neurodegenera-ción existe en cada paciente concreto para individua-lizar el beneficio/riesgo del tratamiento.
Hasta hace unos años, el tratamiento de la EM remitente recidivante (EMRR) con fármacos modifi-cadores de la enfermedad era bastante simple. Solo se podía elegir entre IFN-b y AG. Posteriormente se dispuso de la posibilidad de escalar en el tratamien-to en caso de ineficacia pudiendo elegir entre nata-lizumab (NTZ) y fingolimod. En la actualidad, hay 10 medicamentos aprobados en Europa y 9 en EEUU lo que convierte la decisión de tratamiento en algo complejo que precisa una evaluación de múltiples factores para una toma de decisiones personalizada en cada paciente.
❑ Tratamiento del síndrome clínico aislado (SCA)
El daño axonal ocurre temprano en la EM, y una proporción de pacientes con síndrome clínicamente aislado (SCA) ya tienen disfunción cognitiva dis-creta14. Una presentación multifocal y la carga le-
sional basal en la RM predicen la probabilidad de conversión a esclerosis múltiple clínicamente defi-nida (EMCD)15, 16.
La presencia de un SCA no implica en sí mismo la necesidad de tratamiento con terapias modifica-doras de la enfermedad. Cuanto mayor sea el riesgo de un segundo brote mayor será el beneficio que ob-tenga el paciente en ser tratado. Podemos conside-rar pacientes con SCA de alto riesgo de conversión a EMDC aquellos que presentan 3 o 4 criterios de Barkhof/Tintoré de diseminación en el espacio o al menos 9 lesiones en la resonancia cerebral17. Otros criterios que también aumentarían el riesgo de con-versión a EMDC serían la presencia de bandas oligo-clonales de IgM (lípido-específicas)18, y la presencia de lesiones que captan y no captan contraste en la misma resonancia.
Cinco ensayos clínicos aleatorizados, controla-dos con placebo han demostrado la eficacia del IFN-b y el AG en el tratamiento del SCA: mayor tiempo hasta el siguiente brote y una probabilidad de con-versión a esclerosis múltiple clínicamente definida (EMCD) significativamente más baja y menor nú-mero de nuevas lesiones en T2 o que realzaban con gadolinio15, 19, 20-22. Los fármacos disponibles para el tratamiento de los pacientes con SCA son IFN-b 1a intramuscular (Avonex), IFN-b 1a subcutáneo (Re-bif), IFN-b 1b subcutáneo (Betaferon, Extavia) y acetato de glatiramer (Copaxone). Recientemente se han publicado los resultados favorables de terifluno-mida en el SCA, si bien este fármaco está sólo apro-bado de momento para su uso en EMRR23.
No hay estudios comparativos en pacientes con SCA, pero los estudios comparativos en pacientes con EMRR sugieren que IFN-b 1a y IFN-b 1b subcu-táneos administrados a días alternos pueden prevenir más eficazmente el desarrollo de EMCD que el IFN-b 1a intramuscular24, 25.
El tratamiento temprano puede incluso reducir el riesgo a largo plazo de desarrollar discapacidad per-manente, en relación con el mismo tratamiento ini-ciado posteriormente26.
❑ Tratamiento de la esclerosis múltiple remitente recurrente
Tratamientos de primera líneaEn pacientes con EMRR, hay cuatro fármacos
de primera línea disponibles: tres formulaciones de IFN-b y AG que son tratamientos moduladores de la enfermedad (TME) inyectables disponibles desde hace ya más de 15 años y más recientemente teriflu-nomida y dimetilfumarato (DMF), que son los nue-vos TME orales disponibles.
La comparación de las diferentes formulaciones

13
20
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSión
IFN-b no se basa en ensayos comparativos doble ciego pero parece que las preparaciones subcutáneas son discretamente más eficaces y tienen mayor inci-dencia de síntomas pseudogripales, mientras con la formulación de INF-b 1a intramuscular semanal ha-bría menos reacción cutánea y menor inmunogenici-dad (desarrollo de Nabs)27-30.
El IFN-b-1a sc. podría estar asociado con una ma-yor, aunque muy rara incidencia, de microangiopatía trombótica31, 32. Las diferencias entre los diferentes in-terferones no se consideran clínicamente relevantes.
Tampoco hay diferencia en términos de eficacia clínica y radiológica entre IFN-b y AG33-35. Un re-ciente estudio de fase III (TENERE) ha equiparado teriflunomida 14 mg con IFN-b 1a sc. en términos de reducción de la actividad clínica definida como tiem-po hasta el primer brote y tasa anualizada de brotes (TAB) en una cohorte de 324 pacientes36. Para DMF, el ensayo fase III (CONFIRM) comparó DMF y AG y con placebo37. La comparación post-hoc de DMF frente AG reveló diferencias significativas en la acti-vidad por resonancia magnética con una superioridad de DMF respecto a AG. Sin embargo, este estudio no fue diseñado para probar la superioridad o la no infe-rioridad de DMF en comparación con AG.
Por tanto, la elección de un agente de prime-ra línea se guiará fundamentalmente por el perfil de efectos secundarios (posible tolerancia y toxicidad), comorbilidad, comodidad y previsión de adherencia así como el deseo de embarazo.
La combinación de varios fármacos se ha utili-zado ampliamente en otros campos médicos tales como reumatología o cáncer. En la EM, sin embar-go, el estudio CombiRx ha analizado el efecto de la asociación de IFN-b-1a con AG y no ha encontrado ninguna ventaja significativa de la terapia de combi-nación38. Por otra parte, aunque la asociación de te-rapias con diferentes mecanismos de acción parece atractiva en teoría, la seguridad y los costes son im-portantes preocupaciones al respecto.
Tratamientos de segunda líneaFingolimod, NTZ y alemtuzumab son agentes
que han demostrado superioridad terapéutica respec-to a los agentes de primera línea seleccionados en los ensayos. La mitoxantrona también ha demostrado ser superior a IFN-b, pero como terapia de inducción39.
El estudio TRANSFORMS ha demostrado la eficacia superior de fingolimod oral sobre IFN-b-1a im. en términos de la tasa anualizada de brotes (TAB) y resultados de resonancia magnética en una cohorte de 1153 pacientes40. Ningún ensayo clíni-co ha comparado la eficacia de NTZ sobre los me-dicamentos de primera línea. El estudio SENTINEL ha demostrado la mayor eficacia de la adición NTZ
a IFN-b-1a, en comparación con IFN-b-1a im. solo en una cohorte de pacientes con EM que presentan un fracaso del tratamiento a IFNb-1a41. Sin embargo esta combinación de NTZ con IFNb-1a está contrain-dicada debido a la aparición de 2 casos de LMP con esta asociación. En comparación con IFN-b-1a sc., alemtuzumab redujo significativamente el riesgo de discapacidad en un 42% en el estudio CARE MS II106 y en un 75% en CAMMS223132, y también redujo significativamente la TAB en un 49 y 69%, respecti-vamente. Un seguimiento a largo plazo ampliado con una mediana de 7 años de seguimiento reveló una mejoría o estabilidad de la discapacidad en el 60% de los pacientes42.
No se han realizado los análisis comparativos de eficacia de los agentes de 2ª línea. En un estudio observacional multicéntrico de pacientes con EM tra-tados con NTZ o fingolimod, los resultados del trata-miento fueron similares. Sin embargo, las caracterís-ticas basales de los pacientes eran diferentes43. Otro estudio observacional que comparó NTZ con fingo-limod ha sido publicado recientemente44. Los autores seleccionaron sólo los pacientes en los que se utilizó la serología del VJC para decidir el tratamiento con objeto de garantizar las características de referencia basales. Se encontraron diferencias significativas a favor de NTZ en actividad clínica y de resonancia magnética. No hay estudios comparativos entre NTZ y alemtuzumab.
❑ Escalado o inducción
Existen dos modalidades cuando se inicia un TME en la EM: el escalado y la inducción. La decisión so-bre el mejor plan terapéutico para cada paciente con EM está basada en la actividad previa y actual de la enfermedad (brotes y lesiones nuevas en la RM), la carga de la enfermedad (estado cognitivo, EDSS, el volumen total de lesión en RM, la atrofia cerebral) pero también por el perfil de tolerancia y eventos ad-versos de los diferentes TME, la preferencia del pa-ciente y la experiencia del neurólogo.
Escalado terapéuticoEl escalado terapéutico debe estar respaldado por
una sólida justificación. El tratamiento debe tratar de conseguir el objetivo del mejor NEDA posible con los medicamentos considerados seguros antes de op-tar a terapias más “agresivas’’ que son más eficaces, pero conllevan un mayor riesgo de efectos adversos potencialmente graves o irreversibles. Se comienza con un TME de primera línea en fases iniciales de la EM en pacientes con baja actividad y carga de la en-fermedad, donde prima el perfil de seguridad. Estos pacientes pueden cambiar a un fármaco diferente en

21
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
el caso de falta de tolerancia o de eficacia. Esta estra-tegia requiere monitorización clínica y radiológica. Si se identifican signos de avance de la enfermedad que pueda ser considerada como una respuesta su-bóptima o fracaso del tratamiento se debe plantear un cambio de tratamiento.
Respuesta subóptimaTodos los fármacos de primera línea son sólo
parcialmente eficaces como se ha demostrado tanto en los ensayos clínicos prospectivos como en la vida real45, 46.
Rudick y Polman47 señalan que, dado que aproxi-madamente dos tercios de los pacientes en los en-sayos pivotales con IFN-b y AG tenían brotes y/o actividad por RM, la respuesta subóptima puede con-siderarse “la regla y no la excepción”. Este porcenta-je de no respondedor varía según el criterio exigido.
A nivel radiológico se ha correlacionado la acti-vidad por resonancia magnética con la progresión de la discapacidad en varios estudios48, 49, principalmen-te un aumento significativo de la carga lesional en T2 en los primeros 5 años de la enfermedad50. El efecto del tratamiento durante el primer año también deter-mina la respuesta a medio y largo plazo51-53.
En conjunto hay un buen argumentario para in-cluir las lesiones en T2 y captantes de gadolinio como indicadores de actividad radiológica. Aunque las lesiones en T1 y la atrofia cerebral correlacionan con la aparición de discapacidad resultan menos úti-les en la práctica habitual.
El aumento de la carga lesional en los primeros años16, determinada topografía de las lesiones en Re-sonancia (infratentoriales, medulares)54-56 el acúmulo de atrofia y lesiones en T157 en el contexto de activi-dad clínica (brotes o progresión) inducen a un cam-bio de tratamiento de forma similar a la decisión de tratar en el caso del SCA.
La monitorización por resonancia en el caso de TME de primera línea es fundamental tras un año de inicio de tratamiento58-61. Cuando se trata de TME de segunda línea la monitorización por resonancia no se puede relajar dado que se trata de pacientes agresivos y también por cuestiones de seguridad en algunos ca-sos como el tratamiento con Natalizumab y su riesgo de LMP.
La resonancia debe ser interpretada en combina-ción con la clínica. Los cambios radiológicos de for-ma aislada no deben impactar en la decisión terapéu-tica en el momento actual.
La respuesta subóptima al tratamiento de prime-ra línea no debe ser tolerada en base a: 1) la corre-lación entre la actividad al inicio de la EM y la dis-capacidad futura62-64; 2) el agotamiento de la ventana terapéutica29, 65; 3) el conocimiento de los resultados
desfavorables a largo plazo cuando persiste la activi-dad a pesar del tratamiento con interferón53, 59.
Más difícil es determinar qué cantidad de acti-vidad clínica y radiológica es motivo de cambio de tratamiento.
Una definición clara y consensuada de respuesta subóptima al TME en la EM no existe, pero nume-rosos estudios han sugerido algunos criterios66-75. En 2006, Rio y cols. han evaluado los criterios clínicos, lo que permitiría la identificación temprana de los no respondedores a IFN-b y, a continuación, podría ser utilizado para predecir el estado de discapacidad a largo plazo a los 6 años. Analizaron diferentes crite-rios basados en los brotes, la progresión de la disca-pacidad, o ambas cosas76. En este estudio, después de dos años de tratamiento, la proporción de los no res-pondedores varió del 7-49% de los pacientes en fun-ción de la severidad de los criterios utilizados. Los criterios basados en progresión de la discapacidad (aumento de al menos un punto EDSS confirmado a los 6 meses) mostraron mayor sensibilidad, especi-ficidad y precisión de la discapacidad después de 6 años de tratamiento que los criterios basados en los brotes. Por lo tanto, la progresión de la discapacidad es probablemente más relevante que la tasa de recaí-da para definir un fracaso de IFN-b.
En cuanto a los criterios radiológicos, diferentes estudios han sugerido que la presencia de lesiones re-alzadas con gadolinio o de nuevas lesiones en T2 du-rante la terapia con IFN-b predice una mala respuesta a largo plazo77-81.
Las recomendaciones actuales de la EMA relati-vas a medicamentos de segunda línea incluyen algu-nas definiciones de “no respondedores”. Los pacien-tes con EM son considerados no respondedores si después de un año de tratamiento con IFN-b presen-tan al menos un brote durante la terapia y al menos nueve lesiones T2 o una lesión captante de gadolinio en la resonancia craneal (página web EMA).
Aparte de la EMA, se han propuesto varias es-trategias y algoritmos formales de seguimiento. El Grupo de Trabajo Canadiense de Esclerosis Múltiple (CMSWG) ha publicado en 2004 y 2013 unas direc-trices prácticas para clasificar a los pacientes con EM que reciben TME según el nivel de preocupación res-pecto a la eficacia del tratamiento82. En estas direc-trices incluyen la presencia de brotes, progresión del EDSS y evolución radiológica por resonancia cuya monitorización determina un nivel de preocupación nulo, bajo, medio o alto. Un cambio del tratamiento se debe considerar si existe un alto nivel de preocu-pación en un dominio, un nivel medio de preocu-pación dos dominios cualquiera, o un bajo nivel de preocupación en los tres dominios. En las recomen-daciones revisadas, la CMSWG también sugiere in-
Luis BrieVa ruiz

13
22
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSión
vestigar las funciones cognitivas mediante la Prueba de Symbol Digit Modality Test (SDMT) al menos cada dos o tres años. El Grupo internacional de tra-bajo para la optimización del tratamiento en la EM también ha formulado algunas directrices relativas a la respuesta subóptima83, 84. Recomiendan esperar al menos 6 a 12 meses para evaluar la eficacia. La estrategia de vigilancia se centra en los parámetros habituales (brotes, discapacidad y resonancia magné-tica) para clasificar a los pacientes en uno de los 3 niveles de preocupación. La periodicidad de la visita de seguimiento de los pacientes tratados con TME de primera línea se recomienda cada 6 meses o cada 3 en el caso de presencia de signos la actividad de la enfermedad. La primera resonancia después del ini-cio del tratamiento se puede realizar al año para eva-luar la actividad de la enfermedad y también el pro-nóstico a largo plazo.
Gestión de fracaso del tratamientoLa respuesta subóptima a un TME de primera lí-
nea supone un cambio transversal en algunos casos con bajo nivel de preocupación (de una primera línea a otra primera línea) o un cambio vertical (escalado terapéutico) en casos más agresivos con nivel de pre-ocupación moderado-alto (de una primera línea a una segunda o tercera línea).
Cambio transversalEl cambio de una primera línea a otra primera
línea de TME diferente puede representar una estra-tegia aceptable después del fracaso del tratamiento o la falta de tolerabilidad al mismo85-88. Hay pocos datos disponibles relativos al cambio de TME. Re-cientemente, un estudio observacional español ha informado de la evolución clínica en 180 pacientes después de cambiar un TME de primera línea debi-do a un fracaso del tratamiento89. La mitad de estos pacientes cambió a otro fármaco de primera línea y la otra mitad a una terapia de segunda línea. De los que cambiaron a otro TME de primera línea (es de-cir, IFN-b/IFN-b, IFN-b/AG, AG/IFN-b), todos los grupos presentaron una reducción significativa de su TAB y más del 60% de los pacientes mostraron una ausencia de actividad clínica tras el cambio. Por lo tanto, parece que en los pacientes con EM con un ni-vel bajo-medio de preocupación, el cambio transver-sal de una primera línea a otra puede ser una opción adecuada.
Cambio vertical (escalado)Para los pacientes en los que se ha producido un
avance preocupante de la actividad de la enfermedad durante el TME de primera línea, puede considerarse el escalado a fármacos de segunda línea más efecti-
vos, pero a menudo menos inocuos tales como fingo-limod, NTZ, alemtuzumab o mitoxantrona.
La elección del tratamiento estará guiada por di-ferentes variables: el grado de preocupación respecto al riesgo de empeoramiento de la EM, los posibles eventos adversos asociados con el fármaco a elegir y las características del paciente (edad, comorbilidad, tratamientos concomitantes…).
Si el grado de preocupación se considera bajo-medio, el escalado a fingolimod es una buena opción. Fingolimod ha demostrado su superioridad en com-paración con IFN-b-1a im. en el estudio TRANS-FORMS. En el estudio de extensión90, los pacientes que se habían tratado inicialmente con IFN-b-1a im. fueron reasignados después de un año a fingolimod. La tasa de brotes, el número de lesiones nuevas en T2 y el número de lesiones realzadas con gadolinio disminuyó significativamente después del cambio, en comparación con el año que el paciente estuvo con IFN-b-1a im. Por otra parte, los análisis post-hoc de FREEDOMS y TRANSFORMS91, 92 pusieron de ma-nifiesto que en los pacientes que fueron considerados no respondedores a IFN-b (definido por brotes y ac-tividad en RM), fingolimod redujo significativamente la TAB.
Recientemente, un estudio retrospectivo basado en práctica clínica real valoró el cambio de IFN-b por AG o fingolimod. Los pacientes que cambiaron a fingolimod padecieron menos brotes que aquellos que cambiaron a AG93. Se desconoce si estos resul-tados pueden generalizarse a todos de primera línea.
En caso de que el grado de preocupación sea medio o alto, terapias más agresivas como NTZ, ale-mtuzumab o mitoxantrona son opciones de segunda línea, aunque hay autores que consideran que la mi-toxantrona no debería utilizarse antes de NTZ o fin-golimod116. Actualmente no hay estudios prospecti-vos aleatorizados controlados que comparen NTZ en monoterapia a otros TME. Varios estudios observa-cionales han demostrado una mejora clínica y radio-lógica de NTZ en pacientes con respuesta subóptima a IFN-b o AG94-97.
Alemtuzumab también ha demostrado su efica-cia en pacientes que muestran respuesta subóptima con TME de primera línea. En el estudio CARE MS II, se asignaron pacientes no respondedores a IFN-b o AG a alemtuzumab (12 o 24 mg), IFN-b-1a sc. o placebo133. Se observó una reducción estadísticamen-te significativa en la TAB, discapacidad sostenida y nuevas lesiones en T2 a los 24 meses a favor de ale-mtuzumab frente IFN-b-1a.
Dos ensayos clínicos aleatorios99, 100 han anali-zado el beneficio del tratamiento con mitoxantrona versus placebo en EMRR y EMSP que empeora rá-pidamente. Edan y col. mostraron un beneficio signi-

23
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
ficativo en 42 pacientes con EM después de 6 meses de tratamiento. Está en marcha un estudio prospecti-vo que compara 3 años de tratamiento con NTZ con 6 meses de mitoxantrona seguido de un tratamiento de mantenimiento con cualquier fármaco de primera línea en pacientes EMRR (estudio IQALY-SEP).
Terapia de inducción
¿Cuándo?La actividad inflamatoria temprana (clínica y
radiológica) está relacionada con el riesgo de disca-pacidad a largo plazo y con el futuro desarrollo de EMSP. Los pacientes con EM que presentan brotes frecuentes y un acúmulo importante de lesiones en T2 durante los primeros años de la enfermedad al-canzan discapacidad con mayor rapidez, en compara-ción con los pacientes que no lo hacen6, 50, 101. En este grupo de pacientes con EM especialmente activa, debe ser considerada una terapia de inducción.
Los tratamientos de segunda línea para la EM es-tán asociados con mayor probabilidad de efectos se-cundarios graves y algunos irreversibles.
La estrategia de inducción por tanto generalmen-te se reserva a pacientes con enfermedad muy agre-siva. De hecho, en este grupo de pacientes, el riesgo de discapacidad rápidamente progresiva y definitiva es mayor que la de los eventos adversos asociados con la más intensa inmunosupresión. Una vez que el control de la enfermedad se ha logrado, se realiza un tratamiento de mantenimiento con un fármaco más seguro.
¿Qué fármaco usar?En el tratamiento de inducción en EM se han
estudiado diferentes fármacos: mitoxantrone, NTZ, alemtuzumab y fingolimod.
MitoxantronaUn primer ensayo clínico aleatorizado realizado
en 1997 evaluó los beneficios a corto plazo de una pauta de 6 meses de mitoxantrona versus placebo en un pequeño grupo de pacientes con EMRR o EMSP muy activa99. La mitoxantrona disminuyó significati-vamente la tasa de brotes, el número de lesiones en resonancia, y también proporcionó una cierta mejora en la puntuación EDSS. Un ensayo fase III publicado en 2002 confirmó estos resultados en pacientes con EMRR o EMSP con enfermedad activa y grave102. Otro ensayo clínico aleatorizado publicado en 2011, comparó una inducción de 6 meses con mitoxantro-na seguido de un tratamiento de mantenimiento con IFN-b-1b frente a un tratamiento solo con IFN-b-1b en un grupo de pacientes con EM RR activa. El ries-go de progresión de la discapacidad en 3 años de se
redujo en un 65% en el grupo de mitoxantrona y la TAB y el acúmulo de lesiones T2 se redujeron tam-bién significativamente39.
Datos similares se obtuvieron al utilizar el AG en lugar de IFN-b. La estrategia de inducción por mi-toxantrona seguido de AG resultó segura y eficaz con una disminución sostenida de la actividad por RM103.
NatalizumabLos estudios AFFIRM y SENTINEL han demos-
trado que NTZ es eficaz tanto en monoterapia como en combinación con IFN-b en pacientes con EMRR. Se realizó un análisis post-hoc para determinar la efi-cacia de NTZ en pacientes que presentaban una en-fermedad altamente activa (≥2 brotes en el año an-terior al inicio del estudio y >1 Gd + en la RM)104. NTZ redujo significativamente el riesgo de progre-sión de la discapacidad en un 64% y la tasa de brotes en un 81% en pacientes sin tratamiento previo con enfermedad muy activa y de 58% y 76%, respectiva-mente, en los pacientes con enfermedad muy activa a pesar del tratamiento IFN-b-1a. Estos resultados apuntan a la eficacia importante de NTZ en la EMRR altamente activa.
FingolimodAl igual que NTZ, fingolimod tiene dos indica-
ciones principales: el fracaso a TME de primera lí-nea y la EMRR altamente activa desde el inicio. En el estudio FREEDOMS se llevaron a cabo análisis de subgrupos más allá de 24 meses. Estos subgrupos se definieron de acuerdo a las características demo-gráficas y de la propia enfermedad, así como de la respuesta a la anterior terapia. En pacientes sin tra-tamiento previo y con enfermedad grave que evolu-cionaron rápidamente, la TAB se redujo significati-vamente en el brazo de fingolimod en un 67% frente a placebo a los 24 meses105. Sin embargo, el riesgo de progresión de la discapacidad no fue significante-mente inferior en el grupo de fingolimod en compa-ración con placebo.
AlemtuzumabAlemtuzumab también se prevé como un buen
candidato para la terapia de inducción en la EM. En un estudio doble ciego aleatorizado fase II publicado en 2008 comparando alemtuzumab con IFN-b-1a132, alemtuzumab redujo significativamente la tasa de discapacidad sostenida en un 75% en comparación con IFN-b-1a, así como la TAB y la carga de lesión en RM. La fase de extensión a 5 años demostró una reducción del 72% en el acúmulo de discapacidad y una reducción del 69% en la TAB en comparación con IFN-b-1a98.
El estudio de fase III CARE MS I con pacientes
Luis BrieVa ruiz

13
24
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSión
“naïve” reveló una superioridad de alemtuzumab en comparación con IFN-b-1a en 2 años con respecto a la TAB (disminución del 55%) y en los resultados de RM106. Sin embargo, aunque el riesgo de discapaci-dad confirmada a los 6 meses fue menor en el grupo de alemtuzumab en comparación con el interferón beta-1a, la diferencia no fue estadísticamente signi-ficativa.
La incidencia de acontecimientos adversos gra-ves y persistentes con alemtuzumab limita su uso como agente de inducción a una población seleccio-nada de pacientes que se presentan con un curso de la enfermedad inusualmente agresivo, y sólo después de una cuidadosa consideración de los riesgos y be-neficios de alemtuzumab en comparación con otros TME.
Tratamiento tras la inducciónDespués de la terapia de inducción, la cuestión
del tratamiento de mantenimiento sigue siendo un problema importante. En dos ensayos distintos, ha sido evaluada la eficacia de la terapia de manteni-miento con IFN-b39 o AG107, 108 después de la induc-ción con mitoxantrona. En ambos estudios se ha mantenido la eficacia de forma persistente después de 3 años en el caso de terapia de mantenimiento con IFN-b y 15 meses en el caso de AG.
En cuanto a NTZ, la principal preocupación si-gue siendo el riesgo de rebote de la actividad de la EM inmediatamente después de la interrupción de NTZ109. No queda claro qué medicamento debe uti-lizarse y dentro de qué período de tiempo tendría que ser iniciado para suprimir la actividad de re-bote sin conducir a una excesiva inmunosupresión del SNC. Recientemente, un estudio controlado con placebo, aleatorizado, no ciego (RESTORE) ha evaluado la actividad de la enfermedad en pacien-tes sometidos a la interrupción de NTZ, así como la eficacia clínica de IFN-b-1a im., AG o metilpred-nisolona (MP) en la prevención del rebote. Los pa-cientes tratados con placebo mostraron un aumento significativo de la actividad de resonancia magné-tica (46%) y de los brotes (17%) dentro de 4-12 semanas después de la interrupción de la NTZ. En tanto IFN-b-1a parecía ser eficaz para controlar la actividad radiológica (recurrencia por RM: 7%), en comparación con AG (recurrencia por RM: 53%) o MP (recurrencia por RM: 40%)110. Ninguno de ellos (IFN-b, AG o MP) resultó beneficioso en términos de control de brotes.
Un ensayo clínico ciego aleatorizado: “TOFIN-GO” (Kappos L. ECTRIMS presentación oral 2013) estudió el efecto de diferentes períodos de lavado (8, 12 o 16 semanas) sobre la actividad clínica y radioló-gica en pacientes que cambian de NTZ a fingolimod.
Los resultados preliminares han confirmado que un período de lavado más corto está asociado con un menor riesgo de recurrencia de la enfermedad clínica y por RM. Otro estudio reciente ha demostrado que el relevo de NTZ a fingolimod da lugar a un ligero aumento de la TAB (de 0.26 a 0.38) y que los pacien-tes con un período de lavado de menos de 2 meses presentan un riesgo significativamente menor de bro-te en comparación con aquellos con períodos de la-vado más largos111.
Uno de los mayores retos en el manejo terapéu-tico de los pacientes con EMRR es elegir el fármaco más eficaz en el mejor momento para cada pacien-te. Para los pacientes con EM agresiva clínicamente y radiológicamente, la estrategia de inducción con terapias de segunda línea parece ser más eficaz. En el resto, puede aplicarse el escalado terapéutico para reducir al mínimo la incidencia de eventos adversos graves.
Hay una relativa falta de pruebas que determinen si la estrategia de inducción se podría ampliar para incluir otros pacientes en riesgo de desarrollar disca-pacidad significativa.
❑ Estrategia terapéutica
Si bien los TME disponibles en la actualidad se asig-nan sin gran debate como de primera o segunda línea no hay consenso de cuándo y cómo empezar (escala-do vs. inducción) pero sobre todo cómo cambiar en-tre ellos (transversal entre primeras líneas o escalado de primeras a segundas líneas). Los diferentes mode-los de decisión terapéutica7, 26, 27, 112 tienen pendiente su validación en la práctica clínica diaria como he-rramienta en la decisión de escalado terapéutico.
Los factores para determinar el tratamiento más adecuado en caso de pérdida de eficacia con el trata-miento previo deben tener en cuenta consideraciones relacionadas con el propio paciente además de facto-res clínicos y radiológicos113.
Los factores relacionados con el paciente inclu-yen la tolerabilidad, toxicidad y la adherencia al ré-gimen terapéutico así como a los requerimientos de monitorización.
Los factores clínicos a tener en cuenta son: 1) la comparación de la tasa de brotes durante el tra-tamiento y pre-tratamiento, 2) la tasa, severidad y grado de recuperación de los brotes durante el tra-tamiento, 3) el incremento de discapacidad física y cognitiva, 4) la presencia de anticuerpos neutralizan-tes a IFN-b o NTZ.
Desde el punto de vista radiológico se debe tener en cuenta: 1) el incremento de la carga lesional du-rante el tratamiento, 2) la presencia de lesiones acti-vas (Gd) durante el tratamiento, 3) la aparición de le-

25
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
siones en tronco o médula espinal, 4) el aumento de agujeros negros, 5) y el desarrollo de atrofia cerebral.
La estrategia de tratamiento más utilizada es la monoterapia secuencial en base a una decisión com-partida entre el paciente y el médico114. Se inicia un tratamiento de primera línea y se monitoriza la tasa de brotes, progresión de la discapacidad, la actividad medida por RM, tolerabilidad, seguridad y adheren-cia. El objetivo terapéutico es una remisión completa de la actividad clínica y por RM en ausencia de cual-quier problema de tolerabilidad o de seguridad.
Cualquier cambio de tratamiento debe explorar en primer lugar la motivación para hacerlo: respues-ta inadecuada, tolerabilidad, seguridad o adherencia. El cambio transversal entre inyectables o a alguno de los nuevos tratamientos orales: dimetilfumarato (DMF) o teriflunomida puede ser una opción razona-ble ante problemas de tolerabilidad, seguridad, falta de adherencia o respuesta subóptima con nivel de preocupación bajo medio.
Actualmente no es posible una predicción sobre qué fármaco funcionará mejor en un paciente deter-minado. Por ello son esenciales los estudios observa-cionales y registros de las diferentes terapias secuen-ciales en la práctica clínica real.
Los tratamientos inyectables (IFN-b y AG) tienen un excelente perfil de seguridad a largo plazo pero presentan con frecuencia efectos secundarios, moles-tias derivadas del modo de administración y la posibi-lidad de generar anticuerpos neutralizantes en el caso de IFN115. Aproximadamente el 30% de los pacientes tratados con inyectables tienen una respuesta excelen-te116. El cambio de baja a alta dosis de IFN-b o entre IFN-b y AG, puede resultar en una reducción de la actividad clínica117-120. En otro estudio, sin embargo, el cambio de dosis baja a alta dosis de IFN beta no dio lugar a la estabilización de la enfermedad activa121. Dadas las muchas alternativas disponibles se debe primar el cambio de mecanismo de acción sobre el aumento de dosis del mismo tratamiento que además sólo es una opción válida con IFN.
DMF fue más eficaz en la reducción de brotes que AG37. Sin embargo, AG se incluyó en este es-tudio sólo como un brazo de referencia y no como comparador activo .
No hubo diferencias significativas entre Teriflu-nomida y la dosis alta de IFN-b-1a sc. beta con res-pecto a la prevención de las brotes122 pero sí menos efectos secundarios con el tratamiento oral.
En base a la mayor reducción de la tasa de brotes se ha postulado el uso de DMF en pacientes con ma-yor actividad si no se prevé un problema de adheren-cia o tolerancia, sobre todo a nivel gastrointestinal, en cuyo caso Teriflunomida sería una buena opción36. En este último caso hay que valorar la teratogenici-
dad en mujeres fértiles con intención de embarazo y la frecuencia de las analíticas, quincenales en los pri-meros 6 meses de Teriflunomida. Por el mismo mo-tivo, el cambio de Teriflunomida a DMF parece más lógico que al contrario36.
El escalado a un fármaco más potente como NTZ, fingolimod o alemtuzumab es probablemen-te más eficaz para estabilizar una EM activa que el intercambio entre fármacos de primera línea. Pero la otra cara de estos fármacos más potentes es una re-lación riesgo-beneficio menos favorable. Del cálculo de la agresividad de la enfermedad y del riesgo po-tencial individual con las diferentes opciones resulta la elección del tratamiento.
Varios estudios han demostrado que NTZ estabi-liza al paciente no respondedor a tratamientos de pri-mera línea123-126.
En un ensayo randomizado controlado con pla-cebo (RCP), fingolimod fue más eficaz que el IFN-b- 1a im. en la reducción de actividad de la enfermedad clínica y radiográfica de la EM40.
El cambio de inmunomoduladores inyectables a fingolimod por actividad se ha asociado con un me-nor número de brotes, menor discapacidad y una ma-yor persistencia en comparación con el cambio a otro fármaco inyectable127, 128.
En un estudio con EM activa durante el trata-miento con fármacos inyectables, el cambio a NTZ ha resultado más eficaz que el cambio a fingolimod en términos de tasa de brotes y discapacidad en el primer año129. Otro estudio retrospectivo130 con una en una serie corta de pacientes con EMRR obtuvo los mismo resultados presentando los que recibieron NTZ menor riesgo de brote a pesar de tener mayor actividad de base en comparación con los que reci-bieron fingolimod. En contraposición, otro estudio de práctica clínica habitual fingolimod y natalizumab resultaron de similar eficacia131. Son necesarios ensa-yos clínicos aleatorios comparativos entre fármacos de segunda línea dado que los estudios de práctica clínica no lo son y, por tanto, son vulnerables a la re-gresión a la media. A menudo, además, se mezclan pacientes que cambian por efectos adversos con los que presentan actividad de la enfermedad. Sin em-bargo, avalan el éxito de cambiar el tratamiento si este no funciona.
Con respecto al tratamiento con alemtuzumab, dos ensayos RCP (fase 2 y 3) demostraron un efec-to superior de alemtuzumab en comparación con la dosis alta de IFN-b-1a sc. en variables clínicas y de resonancia magnética en pacientes con EM tratados previamente132. A nivel de progresión alemtuzumab fue superior a IFN beta-1a sc. en el CARE-MS II133
que incluyó pacientes no respondedores a IFN o AG pero no en el CARE-MS I134 con pacientes naïve.
Luis BrieVa ruiz

13
26
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSión
NTZ y fingolimod han sido estudiados en ensayos clínicos con criterios de inclusión similares al resto de tratamientos de primera línea106, 135-137 y ninguno de los dos se ha testado formalmente en estudios RCP para pacientes con respuesta subóptima a los diferentes tra-tamientos de primera línea. Por tanto, la indicación de la EMA como TME de segunda línea refleja el perfil riesgo-beneficio de ambos fármacos por encima de una probada capacidad para estabilizar la EM activa tras una primera línea de tratamiento, algo que se ha documentado a posteriori en estudios observacionales no randomizados de práctica clínica.
Alemtuzumab sí ha demostrado ser más benefi-cioso que IFNb-1a sc. en pacientes no respondedo-res a tratamiento con IFN-b56 pero en este caso con pacientes con enfermedad especialmente activa de-finida como ≥2 brotes en los 2 años anteriores y ≥1 brote en el año anterior. Sin embargo en este estudio el brazo de tratamiento con IFN-b estaba lastrado por su propia ineficacia como tratamiento previo.
Por tanto, el cambio de primera a segunda línea es una buena opción para un paciente con EM acti-va cuando a tenor de los factores pronósticos de su EM138 la probabilidad de discapacidad por EM supe-ra los riesgos del tratamiento de segunda línea esco-gido. La elección del tratamiento de segunda línea debe basarse en el perfil del paciente incluida su co-morbilidad y riesgo individual.
Los criterios de cambio de primera a segunda línea que imponen las agencias reguladoras generan algunas dudas: algunos pacientes con un solo bro-te subjetivo reciente varios años después del inicio del tratamiento y sin cambios en la carga lesional ni lesiones captantes recientes pero con más de nue-ve lesiones en resonancia desde el diagnóstico son susceptibles de un cambio de tratamiento según la EMA. Otros pacientes, sin embargo, no tendrían ac-ceso a un cambio de tratamiento con características
de enfermedad activa grave: ej., caso de la mielitis o neuritis óptica que aumentan la discapacidad sin cambios en resonancia craneal o el caso de actividad inflamatoria por resonancia craneal intensa y persis-tente con carácter subclínico.
El manejo de la fase secundariamente progresiva es un desafío especial sobre todo si se trata de una progresión acelerada. Sólo si hay actividad clínica y radiológica se debe instaurar tratamiento y el único registrado es el interferón y en caso de enfermedad especialmente agresiva la mitoxantrona que ha que-dado relegada a una tercera línea por su perfil de alto riesgo (leucemia y cardiotoxicicidad) y la disponibi-lidad de nuevas alternativas.
❑ Período de lavado
Con la llegada de nuevas terapias en la EM, el mo-mento de cambio de un TME a otro se ha convertido en un tema crucial.
En el caso de cambio de IFN-bs o AG a otras te-rapias o viceversa no se requiere ningún período de lavado, incluso para los medicamentos de segunda línea. Respecto a teriflunomida, la EMA recomien-da no hacer período de lavado cuando se cambia de teriflunomida a IFN-b o AG. Sin embargo, si se trata de un cambio de teriflunomida a otras terapias, como fingolimod, NTZ u otros medicamentos inmu-nosupresores, se recomienda un período de lavado de 3,5 meses (= 5 vidas medias de teriflunomida) o tras un procedimiento de eliminación acelerada con colestiramina o carbón activado. Después de retirar natalizumab habría que esperar menos de dos me-ses en instaurar el siguiente tratamiento. Para DMF y fingolimod, el período de lavado recomendado es el tiempo necesario para recuperar glóbulos blancos normales, por lo general entre uno y dos meses, aun-que puede ser más largo139.
BiBliografía
1.- Trapp BD, Nave KA. Multiple sclerosis: an immune or neurodegenerative disorder? Annu Rev Neurosci 2008;31:247-69.2.- DeLuca GC, Williams K, Evangelou N, Ebers GC, Esiri MM. The contribution of demyelination to axonal loss in multi-
ple sclerosis. Brain 2006;129(Pt 6):1507-16.3.- Kurtzke JF. On the evaluation of disability in multiple sclerosis. Neurology 1961;11:686-94. 4.- Confavreux C, Vukusic S, Moreau T, Adeleine P. Relapses and progression of disability in multiple sclerosis. N Engl J
Med 2000;343:1430-8. 5.- Leray E, Yaouanq J, Le Page E, Coustans M, Laplaud D, Oger J, Edan G. Evidence for a two-stage disability progression
in multiple sclerosis. Brain 2010 Jul;133(Pt7):1900-13.6.- Ebers G, Daumer M, Scalfari A. Predicting a window of therapeutic opportunity in multiple sclerosis. Brain 2010
Dec;133(Pt12):e162.7.- Havrdova E, Galetta S, Stefoski D, Comi G. Freedom from disease activity in multiple sclerosis. Neurology 2010;74
Suppl3:S3-7.

27
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
8.- Stangel M, Penner IK, Boris A. Kallmann BA y col. Towards the implementation of ‘no evidence of disease activity’ in multiple sclerosis treatment: the multiple sclerosis decision model. Therapeutic Advances in Neurological Disorders 2015;8(1):3-13.
9.- Rotstein DL, Healy BC, Malik MT, Chitnis T, Weiner HL. Evaluation of no evidence of disease activity in a 7-year lon-gitudinal multiple sclerosis cohort. JAMA Neurol 2015;72:152-8.
10.- Paolillo A, Pozzilli C, Giugni E, Tomassini V, Gasperini C, Fiorelli M, et al. A 6-year clinical and MRI follow-up study of patients with relapsing-remitting multiple sclerosis treated with Interferon-beta. Eur J Neurol 2002;9:645-55.
11.- Bates D. Treatment effects of immunomodulatory therapies at different stages of multiple sclerosis in short-term trials. Neurology 2011;76(Suppl1):S14-25.
12.- European Study Group on interferon beta-1b in secondary progressive MS. Placebo-controlled multicentre randomised trial of interferon beta-1b in treatment of secondary progressive multiple sclerosis. Lancet 1998;352:1491-7.
13.- Panitch H, Miller A, Paty D, Weinshenker B. North American Study Group on Inter- feron beta-1b in Secondary Pro-gressive MS. Interferon beta-1b in secondary progressive MS: results from a 3-year controlled study. Neurology 2004;63:1788-95.
14.- Potagas C, Giogkaraki E, Koutsis G, et al. Cognitive impairment in different MS subtypes and clinically isolated syn-dromes. J Neurol Sci 2008;267:100-6.
15.- Comi G, Filippi M, Barkhof F, et al. Effect of early interferon treatment on conversion to definite multiple sclerosis: a randomised study. Lancet 2001;357:1576-82.
16.- Tintore M, Rovira A, Rio J, et al. Baseline MRI predicts future attacks and disability in clinically isolated syndromes. Neurology 2006;67:968-72.
17.- Korteweg T, Tintore M, Uitdehaag BM, Knol DL, Vrenken H, Rovira A, Frederiksen J, Miller DH, Fernando K, Filippi M, Agosta F, Rocca MA, Fazekas F, Enzinger C, Parry A, Polman CH, Montalban X, Barkhof F. A search for new MRI criteria for dissemination in space in subjects with a clinically isolated syndrome. Eur Radiol 2009 Sep;19(9):2244-8.
18.- Villar LM, Masjuan J, González-Porqué P, Plaza J, Sádaba MC, Roldán E, Bootello A, Alvarez-Cermeño JC. Intrathecal IgM synthesis is a prognostic factor in multiple sclerosis. Ann Neurol 2003 Feb;53(2):222-6.
19.- Jacobs LD, Beck RW, Simon JH, Kinkel RP, Brownscheidle CM, Murray TJ, Simonian NA, Slasor PJ, Sandrock AW. Intramuscular interferon beta-1a therapy initiated during a first demyelinating event in multiple sclerosis. CHAMPS Study Group. N Engl J Med 2000;343(13):898-904.
20.- Kappos L, Polman CH, Freedman MS, Edan G, Hartung HP, Miller DH, Montalban X, Barkhof F, Bauer L, Jakobs P, Pohl C, Sandbrink R. Treatment with interferon beta-1b delays conversion to clinically definite and McDonald MS in patients with clinically isolated syndromes. Neurology 2006;67(7):1242-9.
21.- Comi G, De Stefano N, Freedman MS, Barkhof F, Polman CH, Uitdehaag BM, Casset-Semanaz F, Hennessy B, Moraga MS, Rocak S, Stubinski B, Kappos L. Comparison of two dosing frequencies of subcutaneous interferon beta-1a in patients with a first clinical demyelinating event suggestive of multiple sclerosis (REFLEX): a phase 3 randomised controlled trial. Lancet Neurol 2012;11(1):33-41.
22.- Comi G, Martinelli V, Rodegher M, Moiola L, Bajenaru O, Carra A, et al. Effect of glatiramer acetate on conversion to clinically definite multiple sclerosis in patients with clinically isolated syndrome (PreCISe study): a randomised, double-blind, placebo-controlled trial. Lancet 2009;374(9700):1503-11.
23.- Miller AE, Wolinsky JS, Kappos L, Comi G, Freedman MS, Olsson TP, Bauer D, Benamor M, Truffinet P, O’Connor PW; TOPIC Study Group. Oral teriflunomide for patients with a first clinical episode suggestive of multiple sclerosis (TOPIC): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Neurol 2014 Oct;13(10):977-86.
24.- Durelli L, Verdun E, Barbero P, et al. Every-other-day interferon beta-1b versus once-weekly interferon beta-1a for mul-tiple sclerosis: results of a 2-year prospective randomised multicentre study (INCOMIN). Lancet 2002;359:1453-60.
25.- Panitch H, Goodin DS, Francis G, et al. Randomized, comparative study of interferon beta-1a treatment regimens in MS: The EVIDENCE trial. Neurology 2002;59:1496-506.
26.- Kinkel RP, Dontchev M, Kollman C, et al. Association between immediate initiation of intramuscular interferon beta-1a at the time of a clinically isolated syndrome and long-term outcomes: a 10-year follow-up of the Controlled High-Risk Avonex Multiple Sclerosis Prevention Study in Ongoing Neurological Surveillance. Arch Neurol 2012;69:183-90.
27.- McGraw CA, Lublin FD. Interferon beta and glatiramer acetate therapy. Neurotherapeu- tics 2013;10:2-18. 28.- Giovannoni GE, Southam, Waubant E. Systematic review of disease-modifying therapies to assess unmet needs in mul-
tiple sclerosis: tolerability and adherence. Mult Scler 2012;18:932-46. 29.- Hegen H, Schleiser M, Gneiss C, Di Pauli F, Ehling R, Kuenz B, et al. Persistency of neutralizing antibodies depends on
titer and interferon-beta preparation. Mult Scler 2012;18:610-5. 30.- La Mantia L, Di Pietrantonj C, Rovaris M, Rigon G, Frau S, Berardo F, et al. Interferons-beta versus glatiramer acetate
for relapsing- remitting multiple sclerosis. Cochrane Database Syst Rev 2014;7:CD009333.
Luis BrieVa ruiz

13
28
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSión
31.- Hunt D, Kavanagh D, Drummond I, Weller B, Bellamy C, Overell J, et al. Thrombotic micro- angiopathy associated with interferon beta. N Engl J Med 2014;370:1270–1.
32.- Larochelle C, Grand’maison F, Bernier GP, Latour M, Cailhier JF, Prat A. Thrombotic thrombocytopenic purpura-hemo-lytic uremic syndrome in relapsing-remitting multiple sclerosis patients on high-dose interferon beta. Mult Scler 2014;20:1783-7.
33.- Mikol DD, Barkhof F, Chang P, Coyle PK, Jeffery DR, Schwid SR, et al. Comparison of subcutaneous interferon beta-1a with glatir- amer acetate in patients with relapsing multi- ple sclerosis (the REbif vs Glatiramer Acetate in Relapsing MS Disease [REGARD] study): a multicentre, randomised, parallel, open-label trial. Lancet Neurol 2008;7: 903-14.
34.- Cadavid D, Wolansky LJ, Skurnick J, Lincoln J, Cheriyan J, Szczepanowski K, et al. Efficacy of treatment of MS with IFNbeta-1b or glatira- mer acetate by monthly brain MRI in the BECOME study. Neurology 2009;72:1976-83.
35.- O’Connor P, Filippi M, Arnason B, Comi G, Cook S, Goodin D, et al. 250 microg or 500 microg interferon beta-1b ver-sus 20 mg glatiramer acetate in relapsing-remitting multiple sclerosis: a prospective, randomised, multicentre study. Lancet Neurol 2009;8:889-97.
36.- Vermersch P, Czlonkowska A, Grimaldi LM, Confavreux C, Comi G, Kappos L, et al. Teriflunomide versus subcutane-ous interferon beta-1a in patients with relapsing multiple sclerosis: a randomised, controlled phase 3 trial. Mult Scler 2014;20:705-16.
37.- Fox RJ, Miller DH, Phillips JT, Hutchinson M, Havrdova E, Kita M, et al. Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis. N Engl J Med 2012;367:1087-97.
38.- Lublin FD, Cofield SS, Cutter GR, Conwit R, Narayana PA, Nelson F, et al. Randomized study combining interferon and glatiramer acetate in multiple sclerosis. Ann Neurol 2013;73:327-40.
39.- Edan G, Comi G, Le Page E, Leray E, Rocca MA, Filippi M. Mitoxantrone prior to inter- feron beta-1b in aggressive relapsing multiple sclerosis: a 3-year randomised trial. J Neurol Neurosurg Psychiatry 2011;82:1344-50.
40.- Cohen JA, Barkhof F, Comi G, Hartung HP, Khatri BO, Montalban X, et al. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010;362:402-15.
41.- Rudick RA, Stuart WH, Calabresi PA, Confavreux C, Galetta SL, Radue EW, et al. Natalizumab plus interferon beta-1a for relapsing multiple sclerosis. N Engl J Med 2006;354:911-23.
42.- Tuohy O, Costelloe L, Hill-Cawthorne G, Bjornson I, Harding K, Robertson N, et al. Alemtuzumab treatment of multiple sclerosis: long-term safety and efficacy. J Neurol Neu- rosurg Psychiatry 2015;86:208-15.
43.- Braune S, Lang M, Bergmann A. Second line use of Fingolimod is as effective as Natalizu- mab in a German out-patient RRMS-cohort. J Neurol 2013;260:2981-5.
44.- Carruthers RL, Rotstein DL, Healy BC, Chitnis T, Weiner HL, Buckle GJ. An observational comparison of natalizumab vs. fingolimod using JCV serology to determine therapy. Mult Scler 2014;20:1381-90.
45.- Mäurer M, Dachsel R, Domke S, Ries S, Reifschneider G, Friedrich A, et al. Health care situation of patients with re-lapsing-remitting multiple sclerosis receiving immunomodulatory therapy: a retrospective survey of more than 9000 German patients with MS. Eur J Neurol Off J Eur Fed Neurol Soc 2011;18:1036-45.
46.- Cocco E, Sardu C, Spinicci G, Musu L, Massa R, Frau J, et al. Influence of treatments in multiple sclerosis dis- ability: A cohort study. Mult Scler Houndmills Basingstoke Engl 2014.
47.- Rudick R, Polman C. (2009) Current approaches to the identification and management of breakthrough disease in pa-tients with multiple sclerosis. Lancet Neurol 8:545-59.
48.- Brex P, Ciccarelli O, O’Riordan J, Sailer M, Thompson A, Miller D. (2002) A longitudinal study of abnormalities on MRI and disability from multiple sclerosis. N Engl J Med 346:158-64.
49.- Weiner H, Guttmann C, Khoury S, Orav E, Hohol M, Kikinis R, et al. (2000) Serial magnetic resonance imaging in mul-tiple sclerosis: correlation with attacks, disability, and disease stage. J Neuroimmunol 104:164-173.
50.- Fisniku L, Brex P, Altmann D, Miszkiel K, Benton C, Lanyon R, et al. (2008) Disability and T2 MRI lesions: a 20-year follow-up of patients with relapse onset of multiple sclerosis. Brain 131:808-17.
51.- Río J, Tintoré M, Sastre-Garriga J, Nos C, Castilló J, Tur C, et al. Change in the clinical activity of multiple sclerosis after treatment switch for suboptimal re- sponse. Eur J Neurol Off J Eur Fed Neurol Soc 2012;19:899-904.
52.- Dobson R, Rudick RA, Turner B, Schmierer K, Giovannoni G. Assessing treatment response to interferon-β: is there a role for MRI? Neurology. 2014 Jan 21;82(3):248-54.
53.- Bermel RA, You X, Foulds P, et al. Predictors of long-term outcome in multiple sclerosis patients treated with interferon beta. Ann Neurol 2013;73:95-103.
54.- Tintore M. Infratentorial lesions are a marker for poor prognosis in multiple sclerosis. Mult Scler 2008;14:S29-293. 55.- Tintore M, Rovira A, Arrambide G, Mitjana R, Río J, Auger C, et al. Brainstem lesions in clinically isolated syndromes.
Neurology 2010;75:1933-8.

29
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
56.- Sombekke MH et al. Spinal cord lesions in patients with clinically isolated syndrome: a powerful tool in diagnosis and prognosis. Neurology 2013;80(1):69-75.
57.- Di Filippo M, Anderson VM, Altmann DR, Swanton JK, Plant GT, Thompson AJ, et al. Brain atrophy and lesion load measures over 1 year relate to clinical status after 6 years in patients with clinically isolated syndromes. J Neurol Neurosurg Psychiatry 2010;81:204-8.
58.- Prosperini L, Gallo V, Petsas N, Borriello G, Pozzilli C. One-year MRI scan predicts clinical response to interferon beta in multiple sclerosis. Eur J Neurol 2009Nov;16(11):1202-9.
59.- Prosperini L, Mancinelli CR, De Giglio L, De Angelis F, Barletta V, Pozzilli C. Interferon beta failure predicted by EMA criteria or isolated MRI activity in multiple sclerosis. Mult Scler Houndmills Basingstoke Engl 2014;20:566-76.
60.- Río J, Tintoré M, Sastre-Garriga J, Nos C, Castilló J, Tur C, et al. Change in the clinical activity of multiple sclerosis after treatment switch for suboptimal re- sponse. Eur J Neurol Off J Eur Fed Neurol Soc 2012;19:899-904.
61.- Sormani MP, Rio J, Tintorè M, Signori A, Li D, Cornelisse P, et al. Scoring treatment response in patients with relapsing multiple sclerosis. Mult Scler Houndmills Basingstoke Engl 2013;19:605-12.
62.- Confavreux C, Vukusic S, Moreau T, Adeleine P. Relapses and progression of disability in multiple sclerosis. N Engl J Med 2000;343:1430-8.
63.- Scalfari A, Neuhaus A, Daumer M, Muraro PA, Ebers GC. Onset of secondary progressive phase and long-term evolution of multiple sclerosis. J Neurol Neurosurg Psychiatry 2014;85:67-75.
64.- Tremlett H, Yousefi M, Devonshire V, Rieckmann P, Zhao Y. UBC Neurologists. Impact of multiple sclerosis relapses on progression diminishes with time. Neurology 2009;73:1616-23.
65.- Leray E, Yaouanq J, Le Page E, Coustans M, Laplaud D, Oger J, et al. Evidence for a two-stage disability progression in multiple sclerosis. Brain J Neurol 2010;133:1900-13.
66.- Fusco C, Andreone V, Coppola G, Luongo V, Guerini F, Pace E, et al. HLA-DRB1*1501 and response to copolymer-1 therapy in relapsing- remitting multiple sclerosis. Neurology 2001;57:1976-9.
67.- Kappos L, Polman C, Pozzilli C, Thompson A, Beckmann K, Dahlke F. Final analysis of the European multicenter trial on IFNbeta-1b in secondary-progressive MS. Neurology 2001;57:1969-75.
68.- Kracke A, von Wussow P, Al-Masri AN, Dalley G, Windhagen A, Heidenreich F. Mx proteins in blood leukocytes for monitoring interferon beta-1b therapy in patients with MS. Neurology 2000;54:193-9.
69.- Rio J, Nos C, Tintoré M, Borrás C, Galán I, Comabella M, et al. Assessment of different treatment failure criteria in a cohort of relapsing-remitting multiple sclerosis patients treated with interferon beta: implications for clinical trials. Ann Neurol 2002;52:400-6.
70.- SturzebecherS, WandingerKP, RosenwaldA, Sathyamoorthy M, Tzou A, Mattar P. Expres- sion profiling identifies re-sponder and non- responder phenotypes to interferon-beta in multiple sclerosis. Brain 2003;126:1419-29.
71.- Villoslada P, Oksenberg JR, Rio J, Montalban X. Clinical characteristics of responders to interferon therapy for relapsing MS. Neurology 2004;62:1653 [author reply 1653].
72.- Wandinger KP, Lünemann JD, Wengert O, Bellmann-Strobl J, Aktas O, Weber A, et al. TNF-related apoptosis in-ducing ligand (TRAIL) as a potential response marker for interferon-beta treatment in multiple sclerosis. Lancet 2003;361:2036-43.
73.- Waubant E, Vukusic S, Gignoux L, Dubief FD, Achiti I, Blanc S, et al. Clinical characteristics of responders to interferon therapy for relap- sing MS. Neurology 2003;61:184-9.
74.- Petzold A, Brassat D, Mas P, Rejdak K, Keir G, Giovannoni G, et al. Treatment response in relation to inflammatory and axonal surrogate marker in multiple sclerosis. Mult Scler 2004;10:281-3.
75.- Rudick RA, Lee JC, Simon J, Ransohoff RM, Fisher E. Defining interferon beta response status in multiple sclerosis patients. Ann Neurol 2004;56:548-55.
76.- Rio J, Nos C, Tintoré M, Téllez N, Galán I, Pelayo R. Defining the response to inter-feron-beta in relapsing-remitting multiple sclerosis patients. Ann Neurol 2006;59:344-52.
77.- Fisniku LK, Brex PA, Altmann DR, Miszkiel KA, Benton CE, Lanyon R, et al. Disability and T2 MRI lesions: a 20-year follow-up of patients with relapse onset of multiple sclerosis. Brain 2008;131:808-17.
78.- Pozzilli C, Prosperini L, Sbardella E, De Giglio L, Onesti E, Tomassini V. Post-marketing survey on clinical response to interferon beta in relapsing multiple sclerosis: the Roman experience. Neurol Sci 2005;26(S4):S174-8.
79.- Tomassini V, Paolillo A, Russo P, Giugni E, Prosperini L, Gasperini C, et al. Predictors of long-term clinical response to interferon beta therapy in relapsing multiple sclerosis. J Neurol 2006;253:287-93.
80.- Rio J, Rovira A, Tintoré M, Huerga E, Nos C, Tellez N, et al. Relationship between MRI lesion activity and response to IFN-beta in relapsing-remitting multiple sclerosis patients. Mult Scler 2008;14:479-84.
81.- Durelli L, Barbero P, Bergui M, Versino E, Bassano MA, Verdun E, et al. MRI activity and neutralising antibody as predic-tors of response to interferon beta treatment in mul- tiple sclerosis. J Neurol Neurosurg Psychiatry 2008;79:646-51.
Luis BrieVa ruiz

13
30
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSión
82.- Freedman MS, Selchen D, Arnold DL, Prat A, Banwell B, Yeung M, et al. Treatment opti- mization in MS: Canadian MS Working Group updated recommendations. Can J Neurol Sci 2013;40:307-23.
83.- International Working Group for Treatment Optimization in MS. Treatment optimization in multiple sclerosis: report of an international consensus meeting. Eur J Neurol 2004;11:43-7.
84.- Karussis D, Biermann LD, Bohlega S, Boiko A, Chofflon M, Fazekas F, et al. A recommended treatment algorithm in relapsing multiple sclerosis: report of an international consensus meeting. Eur J Neurol 2006;13:61-71.
85.- Carra A, Onaha P, Luetic G, Burgos M, Crespo E, Deri N, et al. Therapeutic outcome 3 years after switching of im-munomodulatory thera- pies in patients with relapsing-remitting mul- tiple sclerosis in Argentina. Eur J Neurol 2008;15:386-93.
86.- Caon C, Din M, Ching W, Tselis A, Lisak R, Khan O. Clinical course after change of immu- nomodulating therapy in relapsing-remitting multiple sclerosis. Eur J Neurol 2006;13:471-4.
87.- Gajofatto A, Bacchetti P, Grimes B, High A, Waubant E. Switching first-line disease-mod- ifying therapy after failure: impact on the course of relapsing-remitting multiple sclero- sis. Mult Scler 2009;15:50-8.
88.- Castillo-Trivino T, Mowry EM, Gajofatto A, Chabas D, Crabtree-Hartman E, Cree BA, et al. Switching multiple sclerosis patients with breakthrough disease to second-line therapy. PLoS One 2011;6:e16664.
89.- Rio J, Tintoré M, Sastre-Garriga J, Nos C, Castilló J, Tur C, et al. Change in the clinical activity of multiple sclerosis after treatment switch for suboptimal response. Eur J Neurol 2012;19:899-904.
90.- Khatri B, Barkhof F, Comi G, Hartung HP, Kappos L, Montalban X, et al. Comparison of fingolimod with interferon beta-1a in relapsing-remitting multiple sclerosis: a rando- mised extension of the TRANSFORMS study. Lancet Neurol 2011;10:520-9.
91.- Devonshire V, Havrdova E, Radue EW, O’Connor P, Zhang-Auberson L, Agoropoulou C, et al. Relapse and disability outcomes in patients with multiple sclerosis treated with fingolimod: subgroup analyses of the double-blind, ran-domised, placebo-controlled FREEDOMS study. Lancet Neurol 2012;11:420-8.
92.- Cohen JA, Barkhof F, Comi G, Izquierdo G, Khatri B, Montalban X, et al. Fingolimod versus intramuscular interferon in patient subgroups from TRANSFORMS. J Neurol 2013;260:2023-32.
93.- Bergvall N, Makin C, Lahoz R, Agashivala N, Pradhan A, Capkun G, et al. Relapse rates in patients with multiple sclerosis switching from interferon to fingolimod or glatiramer acetate: a US claims database study. PLoS One 2014;9:e88472.
94.- Belachew S, Phan-Ba R, Bartholomé E, Delvaux V, Hansen I, Calay P, et al. Natalizumab induces a rapid improvement of disability status and ambulation after failure of previous therapy in relapsing-remitting multiple sclerosis. Eur J Neurol 2011;18:240-5.
95.- Prosperini L, Giannì C, Leonardi L, De Giglio L, Borriello G, Galgani S, et al. Escalation to natalizumab or switching among immunomodulators in relapsing multiple sclerosis. Mult Scler 2012;18:64-71.
96.- Putzki N, Kollia K, Woods S, Igwe E, Diener HC, Limmroth V, et al. Natalizumab is effective as second line therapy in the treatment of relapsing remitting multiple sclerosis. Eur J Neurol 2009;16:424-6.
97.- Putzki N, Yaldizli O, Mäurer M, Cursiefen S, Kuckert S, Klawe C, et al. Efficacy of natalizumab in second line therapy of relapsing-remitting multiple sclerosis: results from a multicenter study in German speaking countries. Eur J Neurol 2010;17:31-7.
98.- Coles AJ, Twyman CL, Arnold DL, Cohen JA, Confavreux C, Fox EJ, et al. Alemtuzumab for patients with relapsing multiple sclerosis after disease-modifying therapy: a randomised controlled phase 3 trial. Lancet 2012;380:1829-39.
99.- Edan G, Miller D, Clanet M, Confavreux C, Lyon-Caen O, Lubetzki C, et al. Therapeutic effect of mitoxantrone com-bined with methylprednisolone in multiple sclerosis: a randomised multicentre study of active disease using MRI and clinical criteria. J Neurol Neurosurg Psychiatry 1997;62:112-8.
100.- Hartung HP, Gonsette R, König N, Kwiecinski H, Guseo A, Morrissey SP, et al. Mitoxantrone in progressive multiple sclerosis: a placebo-controlled, double-blind, randomised, multi-centre trial. Lancet 2002;360:2018-25.
101.- Scalfari A, Neuhaus A, Degenhardt A, Rice GP, Muraro PA, Daumer M, et al. The natural history of multiple sclerosis: a geographically based study 10: relapses and long-term disability. Brain 2010;133:1914-29.
102.- Hartung HP, Gonsette R, König N, Kwiecinski H, Guseo A, Morrissey SP, et al. Mitoxantrone in progressive multiple sclerosis: a placebo-controlled, double-blind, randomised, multi-centre trial. Lancet 2002;360:2018-25.
103.- Vollmer T, Panitch H, Bar-Or A, Dunn J, Freedman MS, Gazda SK, et al. Glatiramer acetate after induction therapy with mitoxan- trone in relapsing multiple sclerosis. Mult Scler 2008;14:663-70.
104.- Hutchinson M, Kappos L, Calabresi PA, Con- favreux C, Giovannoni G, Galetta SL, et al. The efficacy of natalizumab in patients with relap- sing multiple sclerosis: subgroup analyses of AFFIRM and SENTINEL. J Neurol 2009;256:405-15.
105.- Devonshire V, Havrdova E, Radue EW, O’Connor P, Zhang-Auberson L, Agoropoulou C, et al. Relapse and disability outcomes in patients with multiple sclerosis treated with fingolimod: subgroup analyses of the double-blind, ran-domised, placebo-controlled FREEDOMS study. Lancet Neurol 2012;11:420-8.

31
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
106.- Cohen JA, Coles AJ, Arnold DL, Confavreux C, Fox EJ, Hartung HP, et al. Alemtuzumab versus interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial. Lancet 2012;380:1819-28.
107.- Vollmer T, Panitch H, Bar-Or A, Dunn J, Freedman MS, Gazda SK, et al. Glatiramer acetate after induction therapy with mitoxan- trone in relapsing multiple sclerosis. Mult Scler 2008;14:663-70.
108.- Arnold DL, Campagnolo D, Panitch H, Bar-Or A, Dunn J, Freedman MS, et al. Glatiramer acetate after mitoxantrone induction improves MRI markers of lesion volume and permanent tissue injury in MS. J Neurol 2008;255:1473-8.
109.- Kerbrat A, Le Page E, Leray E, Anani T, Coustans M, Desormeaux C, et al. Natalizu- mab and drug holiday in clini-cal practice: an observational study in very active relapsing remitting multiple sclerosis patients. J Neurol Sci 2011;308:98-102.
110.- Fox RJ, Cree BA, De Sèze J, Gold R, Hartung HP, Jeffery D, et al. MS disease activity in RESTORE: a randomized 24-week natalizumab treatment interruption study. Neurology 2014;82:1491-8.
111.- Jokubaitis VG, Li V, Kalincik T, Izquierdo G, Hodgkinson S, Alroughani R, et al. Fingoli- mod after natalizumab and the risk of short- term relapse. Neurology 2014;82:1204-11.
112.- Freedman MS, Forrestal FG. Canadian treatment optimization recommendations (TOR) as a predictor of disease break-through in patients with multiple sclerosis treated with interferon beta-1a: analysis of the PRISMS study. Mult Scler 2008 Nov;14(9):1234-41.
113.- Wingerchuk DM, Carter JL. Multiple sclerosis: current and emerging disease-modifying therapies and treat- ment strate-gies. Mayo Clin Proc 2014;89:225-40.
114.- Heesen C, Köpke S, Solari A, Geiger F, Kasper J. Patient autonomy in multiple sclerosis-possible goals and assessment strategies. J Neurol Sci 2013;331:2-9.
115.- Polman CH, Bertolotto A, Deisenhammer F, Giovannoni G, Hartung HP, Hemmer B, Killestein J, McFarland HF, Oger J, Pachner AR, Petkau J, Reder AT, Reingold SC, Schellekens H, Sørensen PS. Recommendations for clinical use of data on neutralising antibodies to interferon-beta therapy in multiple sclerosis. Lancet Neurol 2010 Jul;9(7):740-50.
116.- Sorensen PS. New management algorithms in multiple sclerosis. Curr Opin Neurol 2014 Jun;27(3):246-59. 117.- Gajofatto A, Bacchetti P, Grimes B, High A, Waubant E. Switching first-line disease-modifying therapy after failure: im-
pact on the course of relapsing-remitting multiple sclerosis. Mult Scler Houndmills Basingstoke Engl 2009;15:50-8. 118.- Carrá A, Onaha P, Luetic G, Burgos M, Crespo E, Deri N, et al. Therapeutic outcome 3 years after switching of immu-
nomodulatory therapies in patients with relapsing-remitting multiple sclerosis in Argentina. Eur J Neurol Off J Eur Fed Neurol Soc 2008;15:386-93.
119.- Capobianco M, Rizzo A, Malucchi S, Sperli F, Di Sapio A, Oggero A, et al. Glatiramer acetate is a treatment option in neutralising antibodies to interferon-beta- positive patients. Neurol Sci Off J Ital Neurol Soc Ital Soc Clin Neuro-physiol 2008;29Suppl2:S227-9.
120.- Caon C, Din M, Ching W, Tselis A, Lisak R, Khan O. Clinical course after change of immunomodulating therapy in relapsing-remitting multiple sclerosis. Eur J Neurol Off J Eur Fed Neurol Soc 2006;13:471-4.
121.- Prosperini L, Borriello G, De Giglio L, Leonardi L, Barletta V, Pozzilli C. Management of breakthrough disease in patients with multiple sclerosis: when an increasing of Interferon beta dose should be effective? BMC Neurol 2011;11:26.
122.- Vermersch P, Czlonkowska A, Grimaldi LME, Confavreux C, Comi G, Kappos L, et al. Teriflunomide versus subcutane-ous interferon beta-1a in patients with relapsing multiple sclerosis: a randomised, controlled phase 3 trial. Mult Scler Houndmills Basingstoke Engl 2014;20:705-16.
123.- Castillo-Trivino T, Mowry EM, Gajofatto A, Chabas D, Crabtree-Hartman E, Cree BA, et al. Switching multiple sclerosis patients with breakthrough disease to second- line therapy. PLoS One 2011;6: e16664.
124.- Belachew S, Phan-Ba R, Bartholomé E, Delvaux V, Hansen I, Calay P, et al. Natalizumab induces a rapid improvement of disability status and ambulation after failure of previous therapy in relapsing-remitting multiple sclerosis. Eur J Neurol Off J Eur Fed Neurol Soc 2011;18:240-5.
125.- Putzki N, Kollia K, Woods S, Igwe E, Diener HC, Limmroth V. Natalizumab is effective as second line therapy in the treatment of relapsing remitting multiple sclerosis. Eur J Neurol Off J Eur Fed Neurol Soc 2009;16:424-6.
126.- Prosperini L, Giannì C, Leonardi L, De Giglio L, Borriello G, Galgani S, et al. Escalation to natalizumab or switching among immunomodulators in relapsing multiple sclerosis. Mult Scler Houndmills Basingstoke Engl. 2012;18:64-71.
127.- Bergvall N, Makin C, Lahoz R, Agashivala N, Pradhan A, Capkun G, et al. Relapse rates in patients with multiple sclerosis switching from interferon to fingolimod or glatiramer acetate: a US claims database study. PLoS One 2014;9:e88472.
128.- He A, Spelman T, Jokubaitis V, Havrdova E, Horakova D, Trojano M, et al. Comparison of switch to fingolimod or inter-feron beta/glatiramer acetate in ac- tive multiple sclerosis. JAMA Neurol 2015;1-10.
129.- Kalincik T, Horakova D, Spelman T, Jokubaitis V, Trojano M, Lugaresi A, et al. Switch to natalizumab versus fingolimod in active relapsing- remitting multiple sclerosis. Ann Neurol 2015;77:425-35.
Luis BrieVa ruiz

13
32
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
rEviSión
130.- Gajofatto A, Bijanchi MR, Deotto L, Benedetti MD. Are natalizumab and fingolimod analogous second-line options for the treatment of relapsing-remitting multiple sclerosis? A clinical practice observational study. Eur Neurol 2014;72(3-4):173-80.
131.- Bergvall N, Lahoz R, Reynolds T, Korn JR. Healthcare resource use and relapses with fingolimod versus natalizumab for treating multiple sclerosis: a retrospective US claims database analysis. Curr Med Res Opin 2014;30:1461-71.
132.- CAMMS223 Trial Investigators, Coles AJ, Compston DAS, Selmaj KW, Lake SL, Moran S, et al. Alemtuzumab vs. interferon beta-1a in early multiple sclerosis. N Engl J Med 2008;359:1786-801.
133.- Coles A, Twyman C, Arnold D, Cohen J, Confavreux C, Fox E, et al. (2012b) Alemtuzumab for patients with relapsing multiple sclerosis after disease-modifying therapy: a randomised controlled phase 3 trial. Lancet 380:1829-39.
134.- Cohen J, Coles A, Arnold D, Confavreux C, Fox E, Hartung H, et al. (2012) Alemtuzumab versus interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial. Lancet 380:1819-28.
135.- Kappos L, Radue E-W, O’Connor P, Polman C, Hohlfeld R, Calabresi P, et al. A placebo-controlled trial of oral fingoli-mod in relapsing multiple sclerosis. N Engl J Med 2010;362:387-401.
136.- Calabresi PA, Radue E-W, Goodin D, Jeffery D, Rammohan KW, Reder AT, et al. Safety and efficacy of fingolimod in pa-tients with relapsing-remitting multi- ple sclerosis (FREEDOMS II): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Neurol 2014;13:545-56.
137.- Havrdova E, Galetta S, Hutchinson M, Stefoski D, Bates D, Polman CH, et al. Effect of natalizumab on clinical and radiological disease activity in multiple sclerosis: a retrospective analysis of the Natalizumab Safety and Efficacy in Relapsing-Remitting Multiple Sclerosis (AFFIRM) study. Lancet Neurol 2009;8:254-60.
138.- Miller D, Barkhof F, Montalban X, Thompson A, Filippi M. Clinically isolated syndromes suggestive of multiple sclero-sis, part I: natural history, pathogenesis, diagnosis, and prognosis. Lancet Neurol 2005 May;4(5):281-8.
139.- Johnson TA, Shames I, Keezer M, Lapierre Y, Haegert DG, Bar-Or A, et al. Reconstitution of circulating lymphocyte counts in FTY720-trea- ted MS patients. Clin Immunol 2010;137:15-20.

33
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
novEdadES BiBliográficaS
ana Mª aLonso TorresHospital Regional Universitario de Málaga.
n=22; PP n=15) y con CIS (n=36) y se comparan con los de sujetos control con enfermedades neu-rológicas benignas (n=38). Se realizaron análisis secundarios incluyendo la relación de estos nive-les con la edad, el género, la presencia de BOC en el LCR y las lesiones con captación de gado-linio en RM. Los niveles de α-sinucleína fue-ron significativamente más bajos en los grupos con CIS (78.2±7.5 pg/mL), EMRR (76.8±5.1 pg/mL) y EMPP (76.3±6.7 pg/mL) respecto al grupo control (125.7±13.6 pg/mL). Los análisis secun-darios no mostraron ninguna correlación. En esta cohorte de pacientes con EM y CIS los niveles de α-sinucleína están disminuidos. Son necesarios más estudios para confirmar estos hallazgos y pro-fundizar en la relación biológica entre la EM y la α-sinucleína.
Clínica■› Cognitive impairment in paediatric multiple sclerosis patients is not related to cortical lesionsRocca MA, De Meo E, Amato MP, Copetti M, Moiola L, Ghezzi A, Veggiotti P, Capra R, Fiorino A, Pippolo L, Pera MC, Falini A, Comi G, Filippi M.Multiple Sclerosis 2015 June;21(7):956-9.
Se incluyeron en este trabajo 41 pacientes con EM pediátrica, de los cuales trece (32%) presentaban déficit cognitivo. Los volúmenes de lesiones hi-perintensas en T2 e hipointensas en T1 no se di-ferencian entre los pacientes con deterioro o sin él. El número de lesiones corticales, el volumen de lesiones corticales y el volumen de la sustancia gris tampoco mostraron diferencias. En cambio, el volumen de la sustancia blanca fue significativa-mente menor en los pacientes con deterioro cogni-tivo (p=0.01). Al revés que en los adultos, en los pacientes pediátricos con EM, las lesiones cortica-les no parecen contribuir al déficit cognitivo, que se produce por la afectación de la sustancia blanca.
■› Conversion from clinically isolated syndrome to multiple sclerosis: a large multicentre studyKuhle J, Disanto G, Dobson R, et al.Multiple Sclerosis 2015 July;21(8):1013-24.
Se analiza la capacidad de las distintas variables clínicas y bioquímicas para predecir la conversión
Etiopatogenia■› Effect of smoking cessation on multiple sclerosis prognosis Ramanujam R, Hedström AK, Manouchehrinia A, Alfredsson L, Olsson T, Bottai M, Hillert J.JAMA Neurology 2015 September 8:1-7.
El tabaco es un factor de riesgo reconocido para la esclerosis múltiple, pero no está claro de qué forma afecta a la evolución de la enfermedad. En este trabajo se pretende analizar de qué forma fu-mar tras el diagnóstico afecta al paso a fase pro-gresiva de la EM. Se realiza un estudio incluyen-do pacientes con EM que fumasen en el momento del diagnóstico extraídos del Swedish National MS Registry, entre noviembre de 2008 y diciembre de 2011. Se analizó el tiempo hasta desarrollar EMSP, analizando los años de tabaquismo como variable, así como el sexo, la edad al diagnóstico, el uso de rapé y tabaquismo previo al diagnóstico. Tras el análisis, cada año adicional de tabaquismo tras el diagnóstico aceleró el tiempo de conversión a EMSP en un 4,7%. Las curvas de Kaplan-Meier mostraron que aquellos pacientes que continuaron fumando tras el diagnóstico convirtieron antes a EMSP que los que abandonaron el hábito (alcan-zaron la EMSP a los 48 y 56 años de edad, respec-tivamente). Este estudio proporciona evidencia de que continuar fumando tras el diagnóstico de EM se asocia con un curso evolutivo acelerado y un desarrollo más rápido del curso progresivo. Es ne-cesario, por tanto, aconsejar a los pacientes dejar de fumar tras el diagnóstico de EM, no solo por las posibles comorbilidades, sino por el riesgo de em-peorar la discapacidad asociada a la enfermedad.
■› Decreased levels of alpha-synuclein in cerebrospinal fluid of patients with clinically isolated syndrome and multiple sclerosis Antonelou RCh, Emmanouilidou E, Gasparinatos G, Velona T, Voumvourakis KI, Stefanis L.Journal of Neurochemistry 2015 August;134(4):748-55.
Los niveles de α-sinucleína en el LCR se están postulando como posible biomarcador en varias enfermedades neurodegenerativas, pero se han estudiado poco en las enfermedades desmielini-zantes con neurodegeneración. Se determinan los niveles de α-sinucleína en pacientes con EM (RR

13
34
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
novEdadES BiBliográficaS
de CIS a EM clínicamente definida en una am-plia cohorte internacional. Treinta y tres centros proporcionaron muestras de 1.047 pacientes con CIS con al menos dos años de seguimiento. Se analizó la relación de la conversión a EM con la edad, el sexo, la presentación clínica, las lesiones hiperintensas en T2, las BOC, el índice de IgG y el recuento de células en el LCR; la 25-hidroxi-vitamina D3 y cotinina en suero, y los títulos de IgG contra el antígeno nuclear 1 del Epstein-Barr y contra el Citomegalovirus. El seguimiento me-dio fue de 4.31 años, y en este tiempo 623 CIS convirtieron a EM. En un análisis multivariable los predictores de la conversión fueron las BOC (HR=2.18, IC 95% 1.71-277, p<0.001), el número de lesiones en T2 (de dos a nueve lesiones frente a 0-1: HR=1.97, IC 95% 1.52-2.55, p<0.001; >9 lesiones frente a 0-1: HR=2.74, IC 95% 2.04-3.68, p<0.001), edad al primer episodio (HR aumentan-do inversamente por año=0.98, IC 95% 0.98-0.99, p<0.001). Los niveles bajos de vitamina D se re-lacionaron con la conversión a EM en el análisis simple, pero esta relación se atenuó en el aná-lisis multivariable. Las BOC se asociaron a títu-los mayores de Epstein-Barr. Se validan la carga lesional, las BOC y la edad al diagnóstico como los predictores independientes más fuertes de la conversión a EM. La vitamina D parece estar im-plicada, pero serian necesarios más estudios para analizar su papel.
Diagnóstico■› Benign multiple sclerosis is associated with reduced thinning of the retinal nerve fiber and ganglion cell layers in non-optic-neuritis eyes Huang-Link YM, Fredrikson M, Link H.Journal of Clinical Neurology 2015 July;11(3):241-7.
Resulta difícil diferenciar la esclerosis múltiple de curso benigno de la EMRR basándonos en las características clínicas, la neuroimagen y el análi-sis del LCR. La tomografía de coherencia óptica (OCT) puede emplearse para monitorizar el desa-rrollo y la progresión de la neurodegeneración, lo que puede facilitar la detección de las formas más benignas y ayudar en la elección del tratamien-to. En este trabajo se usa la OCT para detectar la extensión de los cambios en el disco óptico y la mácula en pacientes con EM benigna y EMRR, comparados con controles sanos, con especial inte-rés en los cambios relacionados con la presencia o
ausencia de NO. Se examinan ojos de 36 pacientes (11 EM benigna y 25 EMRR) y 34 controles sanos. La capa de fibras nerviosas de la retina (RNFL) y la capa ganglionar (GCL) fueron significativamen-te más delgadas en los ojos afectados previamente de NO, independientemente del tipo de EM, que en controles. Un adelgazamiento significativo de la capa ganglionar también se observó en los ojos sin antecedentes de neuritis óptica de pacientes con EMRR (no en los de EM benigna) respecto a con-troles. Conjuntamente, se encontró una asociación significativa entre la duración de la enfermedad y las tasas de adelgazamiento de la RNFL y la GCL únicamente entre los ojos sin neuritis óptica de los pacientes con EMRR (-0.54±0.24 y -0.43±0.21 µm/año, p<0.05 para ambos), y no en los pacien-tes con EM Benigna (-0.11±0.27 y -0.24±0.24µm/año). Tanto la RNFL como y la GCL eran más delgadas en pacientes, tanto en ojos con antece-dente de NO como sin él, independientemente del subtipo de enfermedad, siendo mayor en los ojos con NO. El adelgazamiento de la GCL y la tasa de adelgazamiento de ambas capas eran menos pro-nunciados en los ojos sin antecedentes de NO de los pacientes con EM benigna respecto a aquellos con EMRR, pudiendo ser de utilidad para predecir el curso de la enfermedad.
■› Cognitive impairment and memory disorders in relapsing-remitting multiple sclerosis: the role of white matter, gray matter and hippocampus Sacco R, Bisecco A, Corbo D, Della Corte M, d’Ambrosio A, Docimo R, Gallo A, Esposito F, Esposito S, Cirillo M, Lavorgna L, Tedeschi G, Bonavita S.Journal of Neurology 2015 July;262(7):1691-7.
Hasta en un 65% de los pacientes con EM apare-cen problemas cognitivos, que se han relacionado con diferentes medidas de RM de daño cerebral y atrofia cerebral global y regional. En este estudio se analizan las alteraciones tisulares, incluyendo la atrofia hipocampal en los pacientes con EMRR con y sin déficit cognitivo. Se incluyen 46 pacien-tes con EMRR (20 con deterioro cognitivo y 26 sin él) y 25 controles sanos pareados por edad, sexo y nivel educativo. A todos ellos se les realizó evalua-ción neuropsicológica y RM de 3T, determinando la carga lesional en T2 por un método semiautomá-tico y los volúmenes cerebrales de sustancia gris y blanca mediante el método SIENAX. El volumen hipocampal se obtuvo mediante segmentación ma-nual. Respecto a los controles, los pacientes con

35
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
EMRR presentaban atrofia significativa de sustan-cia gris, sustancia blanca e hipocampo izquierdo y derecho (p<0.001). Los pacientes con deterioro cognitivo mostraban mayor carga lesional en T2 (p=0.02) y atrofia de sustancia blanca (p=0.01). En el grupo de EMRR, los test cognitivos se correla-cionaban con la patología cerebral (carga lesional en T2, atrofia de sustancia blanca y atrofia de sus-tancia gris). Únicamente la memoria verbal se co-rrelacionaba con la atrofia hipocampal izquierda. Estos resultados remarcan la importancia de la car-ga lesional en T2 y la atrofia de sustancia blanca en el deterioro cognitivo clínicamente significativo en los pacientes con EM, y demuestra que la atro-fia de sustancia gris y del hipocampo se produce en estos pacientes independientemente de la existen-cia de alteraciones cognitivas.
■› Cerebrospinal fluid CXCL13 in clinically isolated syndrome patients: association with oligoclonal IgM bands and prediction of multiple sclerosis diagnosis Ferraro D, Galli V, Vitetta F, Simone AM, Bedin R, Del Giovane C, Morselli F, Filippini MM, Nichelli PF, Sola P.Journal of Neuroimmunology 2015 June 15;283:64-9.
En este trabajo se correlacionan los niveles en LCR de CXCL13 con marcadores de inflamación intratecal y con la presencia de BOC de IgM, que se han asociado a un curso más grave de la EM. En 110 pacientes con CIS se encontró correlación de los niveles de CXCL13 con el número de cé-lulas y proteínas en LCR, con el índice de IgG y con la presencia de BOC IgM e IgG. Los niveles de CXCL13 ≥15.4 pg/ml presentaron un buen va-lor predictivo positivo y especificidad para el desa-rrollo de EM y para presentar un nuevo brote en el primer año tras el inicio.
■› Corpus callosum atrophy is strongly associated with cognitive impairment in multiple sclerosis: results of a 17-year longitudinal study Granberg T, Martola J, Bergendal G, Shams S, Damangir S, Aspelin P, Fredrikson S, Kristoffersen-Wiberg M.Multiple Sclerosis 2015 August;21(9):1151-8.
En la EM es común la aparición de deterioro cog-nitivo, en ocasiones no diagnosticado. El cuerpo calloso, fundamental para tareas cognitivas que precisan conexión entre áreas cerebrales, está afectado de forma significativa en la EM, y pudie-ra servir como marcador de función cognitiva. Se
siguieron 37 pacientes con EM desde 1996 hasta 2013, junto con un grupo control sano. Se eva-luaron mediante EDSS y Symbol Digit Modalities Test (SDMT), midiéndose el área del cuerpo ca-lloso (CCA) mediante imágenes de RM en T2. La duración de la enfermedad en los pacientes era de 1,6-46 años. La tasa anual de atrofia del cuerpo ca-lloso disminuía con la duración de la enfermedad. El CCA se correlacionaba de forma importante con SDMT (r=0.793, p<0.001) y moderadamente con la EDSS (r=-0.545, p<0.001), tras ajustar por dura-ción de la enfermedad, edad y sexo. La correlación con la fracción parenquimatosa cerebral, fracción de sustancia blanca, fracción de sustancia gris y volumen lesional normalizado fue menos intensa. El área del cuerpo calloso correlaciona bien con la discapacidad física y cognitiva tras casi dos déca-das de seguimiento. Se trata de una medida asequi-ble que puede ayudar a detectar pacientes que pre-cisan una evaluación neuropsicológica.
Tratamiento■› Long-term safety and efficacy of dalfampridine for walking impairment in patients with multiple sclerosis: results of open-label extensions of two phase 3 clinical trialsGoodman AD, Bethoux F, Brown TR, Schapiro RT, Cohen R, Marinucci LN, Henney HR 3rd, Blight AR; MS-F203, MS-F204, and Extension Study Investigators; MS-F203 MS-F204 and Extension Study Investigators.Multiple Sclerosis 2015 September;21(10):1322-31.
En los ensayos doble ciego fase III (MS-F203 y MS-F204) con fampridina de liberación prolonga-da en dosis de 10 mg dos veces al día, mejoró la velocidad de la marcha en los pacientes con EM. En este trabajo se evalúa la seguridad y eficacia a largo plazo en la extensión abierta de ambos estu-dios. Se incluyeron un total de 483 pacientes entre los dos estudios, completando el seguimiento 300 de ellos, con un tiempo máximo de exposición de 3,3 años. No apareció ningún problema nuevo de seguridad, y el perfil de tolerabilidad fue similar a la fase doble ciego. La mejoría en la velocidad de la marcha desapareció tras discontinuar el trata-miento al final de la fase en ciego, pero se recupe-ró tras reiniciar el tratamiento en el seguimiento. A lo largo de la fase de extensión, la velocidad de la marcha disminuyó, pero permaneciendo mejor en los pacientes respondedores respecto a los no res-pondedores.

13
36
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
novEdadES BiBliográficaS
■› GLACIER: an open-label, randomized, multicenter study to assess the safety and tolerability of glatiramer acetate 40mg three-times weekly versus 20mg daily in patients with relapsing-remitting multiple sclerosisWolinsky JS, Borresen TE, Dietrich DW, Wynn D, Sidi Y, Steinerman JR, Knappertz V, Kolodny S; GLACIER Study Group.Multiple Sclerosis Related Disorders 2015 July;4(4):370-6.
Se presentan los datos del ensayo GLACIER, abierto, aleatorizado, en grupos paralelos realiza-do en 31 centros en Estados Unidos entre junio y diciembre de 2013. Se incluyeron pacientes con EMRR estable tratados con acetato de glatirámero 20mg/mL una vez al día por vía subcutánea, alea-torizándolos 1:1 para continuar igual o cambiar a glatirámero 40mg/mL tres veces por semana.
El objetivo primario de este ensayo era la media anualizada de efectos adversos relacionados con la inyección. Adicionalmente se comparan la intensi-dad de estos efectos, la tasa de reacciones locales y la satisfacción subjetiva del paciente con el tra-tamiento. Se aleatorizaron un total de 209 pacien-tes para continuar con 20mg (n=101) o cambiar a 40mg (n=108). En esta dosis, la tasa anualizada de reacciones a la inyección se redujo en un 50% (70.4 vs 35.3 eventos por año, RR=0.50; IC 95% 0.34-0.74; p=0.0006). La reducción en la tasa de efectos adversos moderados-graves fue del 60% (0.9 por año en el grupo de 40 mg vs 2.23 por año en el de 20mg; RR=0.40; p=0.0021). La percep-ción de la conveniencia del tratamiento por los pa-cientes mejoró en el grupo de 40 mg rápidamente tras el cambio, y permaneció estable después.

37
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
agEnda
NoVIEMBRE
■› ISCoRE 2015 (International Spinal Cord Repair)Ciudad: Barcelona (España).Fecha: 6-7 noviembre 2015.Más información: http://www.sen.es/convocatorias-y-actividades/82-otras-convocatorias-actividades/1073-iscore-2015-international-spinal-cord-repair
■› LXVII Reunión Anual de la SENCiudad: Valencia (España).Fecha: 17-21 noviembre 2015.Más información: http://www.sen.es/agenda/icalre-peat.detail/2015/11/17/215/-/lxvii-reunion-anual-de-la-sen
■› 8th Pan Asian Committee for Treatment and Research in Multiple Sclerosis (PACTRIMS)Ciudad: Seoul (South Korea).Fecha: 19-21 noviembre 2015.Más información: http://www.pactrims.org
■› 3RD ASEAN SLEEP CoNGRESS 2015Ciudad: Singapur (Singapur).Fecha: 20-22 noviembre 2015.Más información: http://www.aseansleepcon-gress2015.com
■› 1st International Master Class on diagnosis and treatment of vertigo and balance disordersCiudad: Munich (Alemania).Fecha: 27-28 noviembre 2015.Más información: http://www.sen.es/convocato-rias-y-actividades/82-otras-convocatorias-activi-dades/1127-1st-international-master-class-on-diagno-sis-and-treatment-of-vertigo-and-balance-disorders
DICIEMBRE
■› XXI World Congress on Parkinson’s Disease and Related DisordersCiudad: Milán (Italia).Fecha: 6-9 diciembre 2015.Más información: http://www.oic.it/iaprd2015
■› Cirugía en epilepsia: del niño al adultoCiudad: Barcelona (España).Fecha: 17-18 diciembre 2015.Más información: http://www.sen.es/convocato-rias-y-actividades/82-otras-convocatorias-activi-dades/1138-cirugia-en-epilepsia-del-nino-al-adulto
ENERO
■› V Neuro Interventional Master CourseCiudad: Madrid (España).Fecha: 14-16 enero 2016.Más información: http://neuroimc.com/v-neuroimc-2016
■› 14th MCI Symposium & Early Alzheimer\\\’s Diagnosis & Treatment Workshop Ciudad: Miami Beach (Estados Unidos).Fecha: 16-17 enero 2016.Más información: http://congresos-medicos.com/congreso/14th-mci-symposium-early-alzheimers-diagnosis-treatment-workshop-2028
FEBRERO
■› 3rd International Conference on Heart & Brain (ICHB 2016)Ciudad: París (Francia).Fecha: 25-27 febrero 2016.Más información: http://www.ichb2016.kenes.com
MARzo
■› 53rd Annual Congress of the German League Against EpilepsyCiudad: Jena (Alemania).Fecha: 2-5 marzo 2016.Más información: www.epilepsie2016.de
■› 14th International Athens/Springfield Symposium on Advances in Alzheimer TherapyCiudad: Atenas (Grecia).Fecha: 9-12 marzo 2016.Más información: http://www.ad-springfield.com
■› 2nd International Workshop on High Frequency ocillations in EpilepsyCiudad: Freiburg im Breisgau (Alemania).Fecha: 10-12 marzo 2016.Más información: http://www.hfo2016.de
■› 10th World Congress on Controversies in Neurology (CoNy)Ciudad: Lisboa (Portugal).Fecha: 17-20 marzo 2016.Más información: http://www.comtecmed.com/cony/2016/default.aspx

13
38
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
normaS dE puBlicación
1.- Los trabajos deberán ser enviados para su publicación a Revista Española de Esclerosis Múltiple. Editorial Línea de Comunicación, calle Concha Espina, 8º, 1º derecha, 28036 Ma-drid. Los trabajos se remitirán por correo electrónico ([email protected]) o en soporte digital junto con una copia impresa, indicando el procesador de textos utilizado.
2.- Los trabajos serán evaluados para su publicación siem-pre en el supuesto de no haber sido ya publicados, aceptados para publicación o simultáneamente sometidos para su evalua-ción en otra revista. Los originales aceptados quedarán en pro-piedad de la revista y no podrán ser reimpresos sin permiso de Revista Española de Esclerosis Múltiple.
3.- La Secretaría acusará recibo de los originales e informa-rá de su aceptación. Asimismo, y cuando lo estime oportuno el Consejo Editorial, serán propuestas modificaciones, debiendo los autores remitir el original corregido en un plazo de 15 días a partir de la recepción del citado informe.
Revisiones: trabajos amplios sobre un tema de actualidad, don-de el autor estudia el tema y revisa la bibliografía escrita hasta la fecha sobre éste.
oRiginales: trabajos de tipo prospectivo, de investigación clí-nica, farmacológica o microbiológica, y las contribuciones originales sobre etiología, fisiopatología, anatomía patológica, epidemiología, diagnóstico y tratamiento de las enfermedades. La extensión máxima del texto será de 15 folios y se admitirán 8 figuras y/o tablas, equivalente a 6 páginas de revista inclu-yendo figuras, tablas, fotos y bibliografía.
oRiginales bReves (notas clínicas): trabajos originales de experiencias o estudios clínicos, ensayos terapéuticos o casos clínicos de particular interés, cuya extensión no debe superar 5 folios y 4 figuras y/o tablas.
caRtas al diRectoR: comentarios relativos a artículos recien-tes de la revista, así como observaciones o experiencias que, por su extensión o características, puedan ser resumidas en un texto breve; se admite una tabla y/o figura y un máximo de 10 citas bibliográficas.
otRas secciones: crítica de libros: textos breves (una página de 2.000 espacios) de críticas de libros para su publicación. Asimismo, se publicarán en la sección agenda los congresos, cursos y reuniones relacionados que se remitan.
Secciones de la revista
Envío de manuscritos

39
REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 35 - Septiembre de 2015
Los originales deberán ser mecanografiados a doble espacio (30 líneas, 60 pulsaciones), en DIN-A4 por una sola cara, con un margen no inferior a 25 mm, y con las páginas numeradas correlativamente.
estRuctuRa: el trabajo, en general, deberá estar estructurado en diversos apartados: Introducción, Material y métodos, Re-sultados y Discusión. En trabajos especialmente complejos podrán existir subapartados que ayuden a la comprensión del estudio.
PRimeRa Página: en la primera página figurarán en el orden que se citan:
1.- Título: debe ser conciso e informativo.2.- Nombre completo -sin abreviaturas- y apellidos del au-tor o autores.3.- Centro y Departamento en que se realizó el trabajo.4.- Nombre del autor y dirección postal.5.- Título corto, inferior a 40 caracteres.
Resumen con PalabRas clave: se acompañará un resumen en castellano de unas cuatro líneas y el mismo traducido al inglés, con palabras clave (10 máximo) también en ambos idiomas.
bibliogRafía: las citas se presentarán según el orden de apari-ción en el texto, con numeración correlativa en superíndices, vaya o no acompañada del nombre de los autores en el texto.
Las citas se comprobarán sobre los originales y se orde-narán según las normas de Vancouver disponibles en http://www.icmje.org
ilustRaciones: se podrán publicar en blanco y negro, o a dos colores; si se utilizan fotografías de personas identificables, es necesario tener la autorización para su publicación. Las micro-fotografías deben incluir escala de medidas.
Si las ilustraciones son originales sobre papel o transparen-cia, las fotos han de ser de buena calidad, bien contrastadas. No remita fotocopias.
ilustRaciones digitales: si puede aportar las ilustraciones en formato digital, es recomendable utilizar formato bmp, jpg o tiff, con un mínimo de 300 puntos por pulgada.
Si las figuras no son originales, aun cuando cite la proce-dencia o las modifique, debe obtener permiso de reproducción del autor o de la editorial donde se publicó originalmente.
Presentación y estructura de los trabajos

Con la colaboración de: